Разрешенная реакция
Cтраница 2
В этом случае высвобождается около 33 ккал / моль кинетической энергии. Можно сопоставить эту реакцию с разрешенной реакцией ( 111), где зафиксировано выделение лишь 0 2 ккал / моль. Отметим, что СН2ОН является простым ионом, а не ион-радикалом. Наличие неспаренного электрона результат не определяет. [16]
Полезно помнить одно следствие из этих правил: в разрешенной реакции ( а также в распаде) можно переносить частицы из левой части в правую и наоборот с заменой их на соответствующие античастицы. [17]
Успех теории Вудворда - Хофмана в предсказании стереохимии перициклических реакций выглядит впечатляющим и в результате ведет к кристаллизации определенной точки зрения на химическую реакционную способность. К 1970 г. подавляющее большинство химиков-органиков подписалось под догмой, что вудворд-хофмановские разрешенные реакции протекают легко, в одну стадию и являются процессами, которые могут характеризоваться высокой степенью стереоселективности. С другой стороны, вудворд-хофмановские запрещенные реакции, согласно ожиданиям, протекают через хорошо установленные интермедиа, в которых отсутствует перициклическое связывание, и поэтому должны давать стереохаотический продукт. Кроме того, запрещенность данной реакции, как полагают, подразумевает большую энергию активации, необходимую для превращения реагентов в продукты. [18]
Еще один полезный подход к синхронным реакциям основан на классификации переходных состояний на ароматические и антиароматические так же, как это делается для основных состояний молекул. Стабилизованное или ароматическое переходное состояние характеризуется низкой энергией активации, т.е. соответствует разрешенной реакции. Антиароматическое переходное состояние означает, что существует высокий энергетический барьер, т.е. реакция неблагопрятна или запрещена. Основываясь на этом принципе, можно анализировать возможные переходные состояния синхронных реакций и делать выводы относительно их устойчивости. Такой анализ соответствует решению вопроса об ароматичности или антиароматичности молекул в основном состоянии. [19]
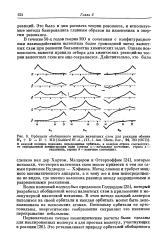 |
Орбитали обобщенного метода валентных схем для реакции обмена Н2 D - Н HD [ GoddardW. A. ni, J. Am. Chem. Soc., 94 793 ( 1972 ]. [20] |
Хартом, Малдером и Остерхоффом [24], которые показали, что теория валентных схем может привести к тем же самым правилам Вудворда - Хофмана. Метод сложен и требует мощного математического аппарата, а к тому же в нем непосредственно не видно, где именно заложена разница между запрещенными и разрешенными реакциями. [21]
Группа CN сильно влияет как на энергию л - ВЗМО и л - НСМО диена, так и на коэффициенты, с которыми Ti-орбитали каждого атома участвуют в граничных орбиталях. Заместители с сильным мезомерным эффектам ( COR, NU2, NMe2 и др.) могут понизить энергию активации запрещенной реакции или повысить энергию активации разрешенной реакции, изменить стерео - и региоселективность реакции или даже сделать циклоприсоеднненне несогласованной реакцией. В последующих разделах этой главы мы обратим внимание на такие случаи. Тем не менее, не всегда наличие указанных заместителей дает нежелательный эффект. [22]
Единственный заместитель понижает симметрию от С2г, до Cs. Введение двух атомов хлора снова повышает симметрию до ( 72, и скорость падает. Тем не менее разрешенные реакции все еще аномально медленны и характеризуются для таких эндотер-мичных процессов все еще очень большими энергиями активации. Не существует очевидной причины, почему вообще должна существовать энергия активации, если бы не было сохраняющихся эффектов, обусловленных исходным барьером симметрии. [23]
 |
Схематическое представление перекрывания заполненных ( заштрихованы и свободных ( не заштрихованы МО Н2, 12 и I. [24] |
Использование диаграмм, таких, как на рис. 21, представляет собой очень простой, но эффективный путь описания бимолекулярных реакций. Положительное перекрывание между ними соответствует разрешенной реакции. Чем больше перекрывание, тем более вероятна реакция, т.е. тем ниже будет энергетический барьер, который может существовать даже для разрешенной реакции. [25]
 |
Корреляционная диаграмма молекулярных орбиталей для реакции Н2 N2 - ifac - N2Ha. сохраняется точечная группа C2t ( tg - и ои-орбитали. [26] |
Однако сближение под углом ведет к чистому положительному перекрыванию и к разрешенной реакции. Это то, что Вудворд и Хофман называли антараповерх-ностным присоединением. Соответствующий процесс i wc - присое-динения назван супраповерхностным присоединением. [27]
Если связь металл - лиганд в первую очередь обусловлена s - орбиталью, ситуация по существу меняется на противоположную. В табл. 4 представлены прогнозы для реакций миграции лиганда в различных гс-системах и для различных ненасыщенных молекул, к которым мигрируют лиганды. Правилом является то, что для rf - орбитального связывания 4и электронов дают ароматические переходные состояния и разрешенные реакции, а 4га 2 электронов дают антиароматические переходные состояния и запрещенные реакции. Когда связывание металла с лигандом обусловлено главным образом s - орбиталью металла, правило меняется на обратное, поскольку эти системы хюккелевские. [28]
В последнее время интерес к химии Д - азиринов значительно возрос. При этом в результате фотохимического раскрытия цикла из азиринов образуются нестойкие нитрил-илиды, которые и участвуют в дальнейших превращениях [ см. разд. Далее будут рассмотрены реакции циклоприсоединения [250], в которых, вероятно, принимает участие неизмененный Д - азириновый цикл, в частности, термически разрешенные реакции [3 2] - и [ я45 - - я2 ] - циклоприсоединения, в которых эти соединения выступают как диполярофилы или диенофилы. [29]
Структура, в которой протон делит связь углерод - углерод пополам, неустойчива, хотя ее энергия не является заметно более высокой. Во всяком случае оставшаяся часть пути реакции должна с энергетической точки зрения идти под гору. Действительная координата реакции для [1,2] - сдвигов в С6Н7 должна приводить сначала к смешиванию орбиталей а и а, чтобы дать необходимое движение слева направо. Характерной чертой разрешенной реакции является то, что симметрия химически важных орбиталей благоприятствует движениям ядер, которые ведут к тг-комплексу низшей энергии. Общая энергия активации невелика. В запрещенной реакции благоприятные движения ядер ведут к тс-комплексу значительно более высокой энергии. Хотя она не запрещена в смысле пересечения орбиталей, энергия активации высока. [30]
Страницы: 1 2 3