Побочная электрохимическая реакция
Cтраница 3
В отношении селективности методов преимущество следует отдать потенциостатической кулонометрии, так как при строгом поддержании постоянного потенциала рабочего электрода в границах площадки предельного тока никакие побочные электрохимические реакции не происходят ( однако сл-едует учитывать сделанные выше замечания, см. стр. [31]
 |
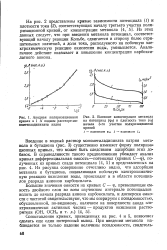
Потенциал на электродной системе ЭЗ-01 / ЭВП-08 при восстановлении хрома железным купоросом. [32] |
Следует отметить еще одну особенность применения редокс-электродов для контроля процесса восстановления хрома: поверхность этих электродов может покрываться продуктами как основных, так и побочных электрохимических реакций, осадками веществ, содержащихся в сточных водах. Вследствие этого электродная система теряет чувствительность и возникает проблема ее восстановления. Решать ее можно различными путями; чаще всего это делают периодической или непрерывной механической очисткой поверхности электродов или промывкой соответствующими растворителями. Для этого погружные промышленные датчики приборов на хром ( СХ-1М) снабжены механическим устройством - сеткой из капроновых нитей, которая совершает возвратно-поступательное движение и очищает поверхность электродов. Устройство приводится в действие портативным электроприводом, укрепленным на головке датчика. От различных замасливателей электроды очищают промывкой растворителями. [33]
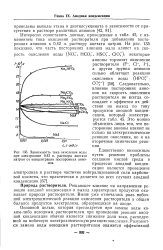 |
Зависимость тока окисления воды при электролизе 0 42 н. раствора ацетата натрия от концентрации посторонних анионов. [34] |
Основной целью, которая преследуется при замене воды каким-либо неводным растворителем при проведении реакции анодной конденсации обычно является снижение доли тока, расходуемой на побочную электрохимическую реакцию окисления. [35]
Из этих данных следует, что при введении метанола потенциал, соответствующий началу реакции Кольбе, сдвигается в сторону более отрицательных значений, а доля тока, расходуемого на побочную электрохимическую реакцию окисления воды, уменьшается. Аналогичное действие оказывает и повышение концентрации карбокси-латного аниона. [37]
Большая концентрация вспомогательного реагента в электролизере обеспечивает высокий, максимально близкий к 100 %, выход по току и служит своего рода кулонометрическим буфером, препятствующим сдвигу потенциала рабочего электрода до значений, при которых возможны побочные электрохимические реакции. Преимуществом косвенной потенциостатической кулонометрии является селективность электродной реакции и возможность последовательного генерирования нескольких титрантов. В данном методе 100 % - ный выход по току обеспечивается автоматически за счет правильного выбора потенциала рабочего электрода. [38]
Система электродов для кулонометрического титрования должна включать генераторный электрод вносимый в камеру ячейки с находящимися в ней определяемым веществом и вспомогательным реагентом, и вспомогательный электрод, который как правило, выносится в отдельную камеру для предотвращения побочных электрохимических реакций на нем. [39]
Повышение концентрации исходного органического вещества, как и в процессах получения неорганических соединений, положительно влияет на выход целевого продукта электролиза, что обычно связано со снижением электродного потенциала, увеличением доли тока на основную электрохимическую реакцию и подавлением побочных электрохимических реакций разложения растворителя. [40]
Область допустимых токов интегрирования, обеспечивающих заданную точность ДИ, ограничена как сверху, так и снизу. Минимальный допустимый ток интегрирования определяется протеканием побочных электрохимических реакций, параллельных основному кулонометрическо-му процессу. [41]
В процессе электросинтеза перхлората целесообразно поддерживать рН 6 6 - i6 8 путем введения соляной кислоты. В более щелочных растворах облегчается протекание побочной электрохимической реакции выделения кислорода. [42]
В процессе электросинтеза перхлората целесообразно поддерживать рН 6 6 - 6 8 путем введения соляной кислоты. В более щелочных растворах облегчается протекание побочной электрохимической реакции выделения кислорода. [43]
При повышении рН раствора зона образования гипохлорита сдвигается в сторону анода, что благоприятствует попаданию ионов ОС1 - на анод и их окислению до хлората. Кроме того, с увеличением рН облегчается побочная электрохимическая реакция выделения кислорода. [44]
Существенно повышается выход по току продуктов анодной конденсаций МойбМетилаДйпината-диметилсебацината при введении в метанольный раствор добавок высших спиртов. Высшие спирты, адсорби - Рзлсь на аноде, подавляют побочную электрохимическую реакцию окисления растворителя ( метанола) и увеличивают долю тока на окисление монометиладипината в диметилсебацинат. [45]
Страницы: 1 2 3 4