Данная электрохимическая реакция
Cтраница 1
Данная электрохимическая реакция предполагает, что ковалентная связь между поверхностным и нижележащим атомами разрывается при появлении двух дырок. [1]
 |
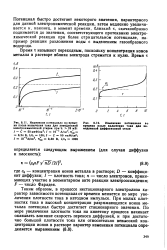
Зависимость величины lg / от обратной температуры для 0 1 М раствора NaCl при различных потенциалах поляризации. [2] |
А - эффективная энергия активации данной электрохимической реакции; R - газовая постоянная. Связь между наклоном прямых на рис. 121 и величиной перенапряжения Де показывает, что электрическое поле в приэлектродном слое благоприятствует течению электрохимической реакции. [3]
Вычислить число электронов, принимающих участие в данной электрохимической реакции, можно несколькими способами: 1) по наклону полярографической волны, 2) по величине нормального диффузионного тока и 3) по кривой сила тока-время, полученной при поляризации с постоянным потенциалом, соответствующим площадке предельного тока. [4]
Потенциал быстро достигает некоторого значения, характерного для данной электрохимической реакции, затем медленно увеличивается и, наконец, в момент времени, близкий т, скачкообразно поднимается до значения, соответствующего протеканию электро-химической реакции при более отрицательном потенциале, например реакции разложения воды с выделением газообразного водорода. [6]
Изолирующий или электропроводный блокирующий пассивирующий слой полностью прекращает данную электрохимическую реакцию на всей закрытой части поверхности электрода. Лишь в порах может происходить реакция в том случае, если она не приводит к пассивации поверхности металла на дне пор. Например, при большой плотности тока в порах может происходить концентрационная поляризация и возникать перенапряжение, в результате которых начинают образовываться другие, растворимые или электропроводные продукты. [7]
Значение нормального электродного потенциала является величиной, характерной для данной электрохимической реакции и не зависящей от концентрации ионов в растворе. Она определяет способность реагирующего иона принимать или отдавать электроны. Чем больше абсолютная величина отрицательного нормального потенциала, тем сильнее стремление металла ( элемента) к ионизации, тем выше его восстановительная способность; с увеличением потенциала возрастает окислительная способность элементов. [8]
Значение нормального электродного потенциала - величина, характерная для данной электрохимической реакции и определяющая способность реагирующего иона принимать или отдавать электроны. [9]
Наряду с этим доступ исходных веществ к электроду, где протекает данная электрохимическая реакция, будет затруднен. [10]
Коэффициент а определяет ту долю потенциала, которая участвует в ускорении данной электрохимической реакции. [11]
 |
Вольт-амперные кривые. [12] |
В ряде случаев получаемые вольт-амперные кривые не совпадают с теоретическими кривыми для данной электрохимической реакции. [13]
На этом основании кинетика электрохимического окисления анилина может быть использована при обсуждении механизма данной электрохимической реакции. [14]
Для вычисления результатов анализа по закону Фарадея необходимо точно измерить количество электричества Q, затраченное в данной электрохимической реакции. [15]
Страницы: 1 2