Значение - валентность
Cтраница 2
Практическое значение координационных чисел сходно со значением валентности, так как знание координационных чисел дает возможность писать формулы различных комплексных соединений. [16]
 |
Схема межатомных взаимодействий в твердом растворе. [17] |
Для характеристики взаимодействия атомов им приписывают определенные атомные радиусы, значения валентности и электроотрицательности. Вводя такие характеристики атомов, следует учитывать факторы, определяющие энергетическое состояние кристалла: геометрический, который создает в нем энергию упругих напряжений, электростатический и химический. [18]
Напишите формулы оксидов фосфора, в которых фосфор проявляет такие же значения валентности, как в указанных соединениях с хлором. [19]
Как видно, количества неспаренных электронов в основном состоянии атомов не находятся в согласии со значениями валентностей, отвечающими положению элементов з периодической системе. [20]
Как видно, количества неспаренных электронов в основном состоянии атомов не находятся в согласии со значениями валентностей, отвечающими положению элементов в периодической системе. [21]
Как видно, число неспареиных электронов в основном состоянии атомов не находятся в согласии со значениями валентностей, отвечающими положению элементов в периодической системе. [22]
Как видно, число неспаренных электронов в основном состоянии атомов не находится в согласии со значениями валентностей, отвечающими положению эле ментов в периодической системе. [23]
В этой таблице для каждого из элементов приведены химические обозначения, атомные и эквивалентные веса и значения валентности. Атомным весом называется число, показывающее, во сколько раз вес атома химического элемента больше одной шестнадцатой веса атома кислорода; атомный вес выражается в кислородных единицах. Эквивалентным весом называется весовое количество элемента, соединяющееся с одной ( точнее 1 008) весовой частью водорода или восемью весовыми частями кислорода. Химические элементы соединяются между собой в весовых количествах, соответствующих их эквивалентным весам. Частное от деления атомного веса на эквивалентный вес называется валентностью рассматриваемого элемента. Так, например, атомный вес магния 24 3, а эквивалентный вес его 12 15; следовательно, магний двухвалентен. [24]
В тех случаях, когда валентность комплексообразующего иона имеет постоянное значение, следует опускать приставку, характеризующую значение валентности. [25]
Характер и численное значение валентности часто обозначают символом элемента, справа и вверху которого указывается римской цифрой значение валентности, а знаками или - ее характер. [26]
Поскольку для некоторых элементов существует несколько эквивалентных весов, то отсюда следовало, что для таких элементов имеется несколько значений валентности. [27]
На основании знаний учащихся о химической связи легко перейти к электронной сущности валентности как свойству атомов образовывать химическую связь, а также к значению валентности, определяемой числом связей, образованных атомом или числом электронов, участвующих в ее образовании. Степень окисления - понятие необходимое, но формальное. Эти два понятия необходимо четко разграничивать. [28]
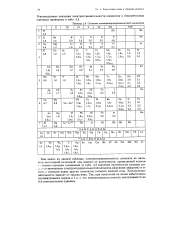 |
Система электроотрицателъностеи элементов. [29] |
Как видно из данной таблицы, электроотрицательность элемента не является постоянной величиной: она зависит от валентности, проявляемой атомом г соответствующем соединении ( в табл. 4.2 значения валентности указаны рядом со значениями электроотрицательностей элемента римскими цифрами) и от того, с атомами каких других элементов соединен данный атом. Электроотрицательность зависит от заряда иона. [30]
Страницы: 1 2 3 4