Многоступенчатая реакция
Cтраница 1
Многоступенчатая реакция, каждый этап которой связан с сохранением конфигурации. Этот вариант был обнаружен при изучении цис транс-изомеризации [ Pd ат2С12 ], которая катализируется избытком амина ( am), причем скорость реакции зависит от нуклеофильности амина. [2]
Многоступенчатая реакция с несколькими М при произвольных значениях констант скорости uf lp i, очевидно, не может быть представлена в виде суммы многоступенчатых реакций, каждая из которых относится к одному определенному значению Ny. [3]
Многоступенчатые реакции, подобные описанным выше, встречаются и в некаталитических системах. [4]
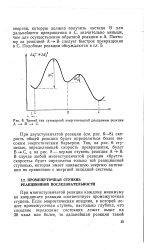 |
Третий тип суммарной энергетической диаграммы реакции А - В - С. [5] |
При многоступенчатой реакции каждому минимуму по координате реакции соответствует промежуточная ступень. [6]
В случае многоступенчатой реакции действие яда сначала приводит к прекращению лишь некоторых стадий. [7]
В этой многоступенчатой реакции ffNH3 выделяется в первой стадии, а оксил олефина взаимодействует с аминогруппой во второй стадии. [8]
Действительный же процесс представляется сложной многоступенчатой реакцией, которая в некоторых условиях не доходит до конца. Вследствие этого в продуктах реакции наряду с пятиокисью фосфора в том или ином количестве могут присутствовать и окислы низших степеней окисления. [9]
Как уже обсуждалось в разделе 1.1.3, существуют многоступенчатые реакции, для которых стадии, определяющей скорость процесса, предшествует одно или несколько быстро устанавливающихся равновесий. Если обратное течение первой стадии является мономолекулярной реакцией, то для обнаружения предшествующего равновесия можно привлечь сте-реохимические данные или эксперименты с мечеными соединениями. В случае же, когда обращение первой стадии представляет собой бимолекулярную реакцию, дополнительные сведения можно получить из явлений обмена или уравнения скорости реакции. [10]
Разбор дополнительных вариантов, как, например, многоступенчатых реакций, которые, несомненно, возможны в ряде систем, не добавило бы ничего существенно нового к общим функциональным зависимостям; возможно изменение формы кривых в деталях. [11]
В другой гипотезе схема процесса представлена в виде многоступенчатой реакции, протекающей по-разному в кислой и щелочной средах. Согласно этой гипотезе, восстановление иона никеля осуществляется путем получения им электрона от металла, катализирующего эту реакцию, в то время как передача электронов от гипофосфита к металлу происходит посредством радикала ОН в щелочной среде и радикала Н2РОг - в кислой среде. Такое объяснение механизма процесса частично согласуется с экспериментальными данными. Однако выделение водорода, неизбежно сопутствующее восстановлению никеля, и образование фосфора не получают должного объяснения. [12]
Вопрос о выборе области протекания процесса усложняется в случае многоступенчатых реакций. При этом максимальная селективность и скорость процесса могут иметь место как в чисто кинетической или чисто диффузионной области ( по всем компонентам, способным к дальнейшему превращению), так и в смешанной области, когда имеет место фазовое равновесие по одним компонентам и отсутствует по другим. [13]
Таким образом, анализ составления системы дифференциальных уравнений скоростей многоступенчатых реакций, построенный на базе закона действующих масс, и анализ материального баланса стехиометрических уравнений по всем ступеням, с помощью которого было решено дифференциальное уравнение скорости реакции первой ступени, показал следующее. Если указанный материальный баланс проведен на молекулярном, на микроуровне, то дифференциальные уравнения скоростей многоступенчатых реакций описывают некоторое макросостояние рассматриваемого процесса. Следовательно, обнаружено очень серьезное принципиальное несоответствие между методами решения первого дифференциального уравнения и составлением системы дифференциальных уравнений скоростей реакций для многоступенчатого процесса. [14]
Нелинейная зависимость скорости реакции от а может встречаться при многоступенчатых реакциях, когда под действием заместителей меняется стадия, определяющая скорость реакции. [15]
Страницы: 1 2 3
