Равновесная реакция
Cтраница 1
Равновесная реакция, ведущая к образованию полуацеталей и полукеталей, катализируется и кислотами, и основаниями. [1]
Равновесная реакция, доводимая до конца непрерывным удалением одного из продуктов. [2]
Равновесная реакция ( 10) сильно зависит от кислотности среды; в более кислой среде равновесие смещается влево. Варьировать количество сернокислого натрия в растворе невозможно: его количество лимитировано количеством фтористого натрия, применяемого для разложения берилла, а уменьшать его нельзя, так как это может привести к неполному разложению минерала. [3]
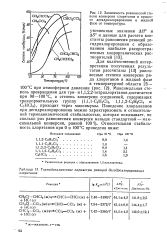 |
Зависимость равновесной степени конверсии хлорэтанов в процессе дегидрохлорирования в жидкой фазе от температуры.| Термодинамические параметры реакций дегидрохлорирования - хлорэтанов. [4] |
Равновесная реакция с образованием 1 2-дихлорэтена. [5]
Равновесные реакции ( 1) - ( 3) соответствуют обычному механизму, а реакции ( 2) - ( 7) - классическому бифункциональному механизму. Наличие гидрирующего металла обеспечивает равновесие парафины олефины, поэтому концентрация карбониевых ионов в полостях цеолита зависит от парциального давления водорода. [6]
Равновесная реакция, доводимая до конца непрерывным удалением одного из продуктов. [7]
Указанные равновесные реакции протекают с различной скоростью в зависимости от термической устойчивости промежуточных компонентов смеси. Устойчивость различных углеводородных молекул уменьшается в следующем порядке: а) при изомеризации гексанов: 2-метилпентан а, н-гексан, 2 3-диметилбутан, 2 2-ди-метилбутан; б) для гептанов: 2 4-диметилпентан, 2 3-диметил-пентан, к-гептан, 2 2 3-триметилбутан. Первичной стадией изомеризации н-гексана, к-гептана и к-октана является образование метилзамещенных изомеров. [8]
Равновесная реакция As B имеет первые порядки в обоих направлениях. Найдите выражение для концентрации А в зависимости от времени, если первоначальные количества А и В равны [ А ] 0 и [ В ] 0 соответственно. [9]
Равновесные реакции димстилсилоксана [ ( CHsbSiO ], являются в настоящее время наиболее изученными. [10]
Указанные равновесные реакции протекают с различной скоростью в зависимости от термической устойчивости промежуточных компонентов смеси. Устойчивость различных углеводородных молекул уменьшается в следующем порядке: а) при изомеризации гексанов: 2-метилпентан а, к-гексан, 2 3-диметилбутан, 2 2-ди-метилбутан; б) для гептанов: 2 4-диметилпентан, 2 3-диметил-пентан, к-гептан, 2 2 3-триметилбутан. Первичной стадией изомеризации к-гексана, к-гептана и н-октана является образование метилзамещенных изомеров. [11]
Подобная равновесная реакция имеет место и для замещенных этилениминов, причем скорости прямой и обратной реакций зависят от природы заместителей. [12]
Равновесная реакция образования комплекса, уравнение которой написано выше ( стр. [13]
Равновесная реакция взаимодействия углеводородов с паром или кислородом при температуре выше 850 С обеспечивает выход водорода и окиси углерода. [14]
Равновесная реакция карбоновых кислот ( 7) с пероксидом водорода, ведущая к образованию пероксикислот ( 8) в отсутствие сильно кислых катализаторов протекает медленно. Реакция равновесна, и ее можно сдвинуть в сторону образования пероксикислоты добавлением концентрированного пе-роксида водорода. Безводные пероксикислоты получают в неводных растворах с использованием кислых ионообменных смол в качестве катализатора. [15]
Страницы: 1 2 3 4