Химическая реакция - первый порядок
Cтраница 2
Для других более разветвленных схем химических реакций первого порядка дифференциальные уравнения кинетики составляются в соответствии с законом действия масс так же, как это было изложено здесь. [16]
 |
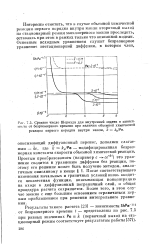
Сопоставление экспериментальных и расчетных значений молекулярного веса при механо1 деструкции ( кривые - экспериментальные данные. точки - расчетные. [17] |
Приведенное уравнение аналогично уравнению кинетики химических реакций первого порядка и отличается от него тем, что концентрации в данном случае заменены величинами, пропорциональными длине цепи полимера, участвующего в мехайодеструкций. [18]
 |
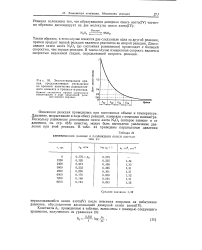
Среднее число Шервуда для внутренней задачи в зависимости от безразмерного времени при наличии объемной химической. [19] |
Интересно отметить, что в случае объемной химической реакции первого порядка внутри капли вторичный выход на стационарный режим массонереноса можно проследить, оставаясь при этом, в рамках только что описанной модели. [20]
 |
Экспоненциальная кривая, представляющая уменьшение во времени количества радиоактивного элемента в процессе а-распада. [21] |
Кривая аналогична кривой уменьшения концентрации в ходе химической реакции первого порядка. [22]
Уравнение (1.32) характеризует зависимость концентрации от времени для химических реакций первого порядка. Так как в уравнение (1.31) концентрация вещества входит в виде отношения, то константа скорости реакции первого порядка не будет зависеть от размерности времени. Если в первую минуту прореагировала 1 / 100 часть от общего количества исходного вещества, то через минуту прореагирует столько же от оставшихся 99 частей исходного вещества. [23]
Например, пусть в изотермическом периодическом реакторе проводят химическую реакцию первого порядка. [24]
Это положение справедливо и для абсорбции, сопровождающейся химической реакцией первого порядка. Однако из рассмотренных работ по кинетике реакций второго порядка следует, что коэффициент массопередачи является функцией движущей силы. [25]
Пусть в потоке протекает изотермически и без изменения объема химическая реакция первого порядка; ее математическое описание представлено в разд. Воспроизведем здесь эти выражения, обозначив концентрацию реагента символом С. [26]
К K CS K C0 представляют обычную константу скорости химической реакции первого порядка. Константа К в данном случае выражается через расход твердой фазы. [27]
Подобное дифференциальное уравнение может быть написано также и для химических реакций первого порядка. [28]
Заметим, что уравнение ( 27) аналогично рассмотренной выше химической реакции первого порядка, а допущение об избытке растительной пищи аналогично предположению о том, что вещество А в реакции Лотки находится в избытке. [29]
Теперь рассмотрим условия, когда вещество А вступает в химическую реакцию первого порядка, протекающую на поверхности извилистых каналов катализатора. [30]
Страницы: 1 2 3