Химическая реакция - первый порядок
Cтраница 3
При А 0 это уравнение описывает процессы массопереноса с объемной химической реакцией первого порядка. К уравнению Гельмгольца приводится любое уравнение эллиптического типа с постоянными коэффициентами. [31]
К существенным теоретическим выводам этой главы относятся закономерности кинетики протекания химической реакции первого порядка, когда растворенные молекулы диффундируют от межфазной границы в жидкую фазу, и реакции второго порядка при взаимодействии растворенных молекул газа с нелетучим реагентом, который находится в жидкой фазе и диффундирует к границе раздела, где встречается с поступающими молекулами газа. Показано, что в этих двух случаях влияние реакции может быть совершенно различным и что скорость массопередачи может быть не пропорциональна движущей силе, особенно при протекании бимолекулярной реакции. Рассмотрены примеры применения теории, включая определение скоростей абсорбции оксидов азота в воде и в растворах кислот, анализ абсорбции диоксида углерода щелочными буферными системами, а также процесса окисления сульфита железа в водном растворе. [32]
При поглощении газа раствором процесс диффузии газа в раствор сопровождается химической реакцией первого порядка, скорость которой пропорциональна концентрации растворенного в жидкости газа. Скорость диффузии в жидкости принимается пропорциональной градиенту концентрации. [33]
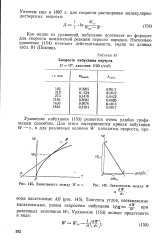 |
Скорость набухания каучука.| Зависимость между IF и т. [ IMAGE ] Зависимость между W. [34] |
Как видно из уравнений, набухание протекает по формуле для скорости химической реакции первого порядка. [35]
При Ф 0 это уравнение описывает одномерный нестационарный конвективный массоперенос с объемной химической реакцией первого порядка в движущейся с постоянной скоростью сплошной среде. Аналогичное уравнение используется для анализа соответствующих одномерных тепловых процессов в движущейся среде с объемным тепловыделением, пропорциональным температуре. [36]
В случае, если скорость встраивания молекул в кристалл протекает аналогично скорости химической реакции первого порядка, величину К. [37]
Теперь мы рассмотрим разложение N2O5, растворенного в тетрахлориде углерода, в качестве примера химической реакции первого порядка. Твердый N2O5 и один из продуктов его разложения, NO2, растворимы в СС14; другой продукт, О2, нерастворим в нем. [38]
Метод [94], использованный при решении задачи о массопере-носе внутри пузырька газа при наличии химической реакции первого порядка для случая, когда Ре - 0, можно применить и для случая, когда Ре - оо. [39]
Заметим, что уравнение для радиоактивного распада (2.4) совершенно аналогично уравнению, описывающему протекание химической реакции первого порядка. [40]
Как известно [41, 48], большинство реакций, сопровождающих процессы обезвреживания СВ, относится к химическим реакциям первого порядка. [41]
Представленные в данном разделе результаты исследований показывают, что при комнатной температуре рассматриваемые процессы абсорбции сопровождаются химической реакцией первого порядка. [42]
Вебер [13] вывел уравнение для тока электродного процесса, при котором деполяризатор регенерируется в растворе в результате химической реакции первого порядка. [43]
Страницы: 1 2 3