Сама химическая реакция
Cтраница 2
Химические свойства образующейся горючей смейй, а следовательно, и химические свойства самого топлива перестают в этих случаях играть решающую роль в смысле воздействия на скорость выгорания смеси, так как в нормальных случаях во фронте пламени развиваются столь высокие температуры, что сама химическая реакция начинает протекать практически мгновенно и не задерживает горение: сколько горючей смеси успевает образоваться, столько ее немедленно и выгорает. Вследствие этого в области достаточно развившегося беспорядочно-смесительного течения газа происходит резкое уменьшение длины горящего факела, которая после известного предела остается одной и той же, не изменяясь при дальнейшем увеличении скорости потока ( фиг. [16]
Таким образом, в качестве исходного при исследовании процесса обжига карбоната кальция в условиях съема пленки твердого продукта реакции должно быть положено такое кинетическое уравнение, в котором взаимосвязанно учитывались бы теплоотдача к поверхности реагирующей частицы от окружающей ее среды, теплопроводность растущего слоя твердого продукта реакции, диффузия газообразного продукта через слой твердого продукта реакции и сама химическая реакция. [17]
Если, например, стадия 1 определяет скорость, то общая скорость не зависит от химической реакции и процесс может рассматриваться как простое явление массопереноса, которое не зависит от скорости реакции. Сама химическая реакция может быть причиной высокой общей скорости массопереноса в пределах фазы 2 и поэтому стадия 1 будет лимитировать скорость. [18]
Для того чтобы управлять такими реакциями, необходимо, во-первых, установить механизм подвода реагирующих веществ в зону реакции через слой твердых реагентов или слой продуктов реакции и, во-вторых, вывести уравнения, описывающие кинетику каждой данной реакции. В большинстве случаев сама химическая реакция на межфазовой границе при повышенных температурах протекает достаточно быстро, и скорость суммарного процесса определяется процессом переноса или диффузии реагентов. При этом перенос вещества может происходить не только через решетку, но и по границам зерен в поликристалле. Совокупность этих процессов называют диффузионными явлениями, которые характеризуются коэффициентом диффузии D. При всех количественных исследованиях экспериментально или теоретически определяют величину D и ее зависимость от внешних условий, природы компонентов и структурных дефектов твердых тел. [19]
Химическая промышленность включает в себя большое число отраслей, объединяющих близкие по характеру производства. Во всех этих отраслях сама химическая реакция составляет лишь небольшую часть технологии. [20]
В течение длительного времени считалось, что химическая связь может быть нарушена только при какой-либо химической реакции, приводящей к изменению строения молекулы. Было также известно, что и сами химические реакции могут инициироваться нагреванием или облучением ультрафиолетовым светом. [21]
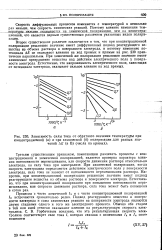 |
Зависимость силы тока от обратного значения температуры при концентрационной ( а и при химической ( 6 поляризации для разных значений Е ( в В ( числа на кривых. [22] |
Процессы с чисто химической / х и с чисто концентрационной поляризацией / к встречаются сравнительно редко. Подвод реагирующего вещества к поверхности электрода и сама химическая реакция на поверхности электрода являются двумя стадиями одного и того же электродного процесса. Обычно обе стадии в той или иной степени оказывают влияние на результирующую скорость электролиза. [23]
Процесс кристаллизации твердого, как правило, экзотерми-чен; в связи с этим необходимо предусматривать отвод тепла от аппаратов с помощью змеевика или рубашки. Что же касается процесса осаждения, то сама химическая реакция осаждения может быть как экзотермичной, так и эндотермичной. Суммарный тепловой эффект процесса равен алгебраической сумме теплот химического взаимодействия и кристаллизации. Поэтому в ряде случаев необходим подвод тепла. [24]
Скорость реакции определяется скоростью процессов удаления образующихся продуктов. Если процессы удаления существенно медленнее, чем собственно сама химическая реакция, то они определяют скорость общего процесса. Примером может быть тление твердых веществ, при котором реакции проходят у граничной поверхности газообразных и твердых фаз. Скорость реакции при этом определяется адсорбционными процессами. Здесь действительно уравнение, найденное Ленгмюром. [25]
Поэтому на общую скорость процесса влияет растворимость ароматического углеводорода в серной кислоте или олеуме, а также скорость диффузии и поверхность контакта фаз. Последние два фактора очень существенны при сульфировании олеумом, когда сама химическая реакция протекает быстро. Для процесса с серной кислотой химическая реакция является медленной стадией, определяющей скорость процесса. [26]
Приведенные примеры показывают, что многие основные реак-I, протекающие в активных центрах ферментов, можно моде-э, используя взаимодействие обычных органических corn в отсутствие белков. Роль последних заключается в уз-субстратов и их ориентации, а сама химическая реакция часто осуществляется под действием кофакторов ( коферментов), которые в свою очередь должны специфически узнаваться белками или ферментами. Последняя глава этой книги посвящена химическим аспектам функционирования коферментов и их строению. [27]
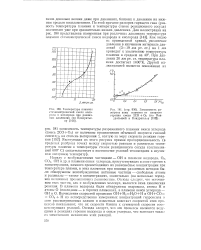 |
Температура пламени стехиометрической смеси водорода и кислорода при различных давлениях ( по Кондратье-ву [ ИЗ ]. [28] |
Наряду с возбужденными частицами - ОН в пламени водорода, О2, СО2, ОН и др. в пламени окиси углерода, присутствующих в зоне горения в концентрациях, намного превосходящих их равновесные концентрации при температуре пламен, в этих пламенах при помощи различных методов были обнаружены невозбужденные активные частицы - свободные атомы и радикалы - также в концентрациях, значительно ( на несколько порядков величины) превышающих равновесные. Отсюда следует, что источником этих частиц, как и возбужденных молекул, является сама химическая реакция. В пламени водорода были обнаружены гидроксил, атомы Н и атомы О ( последние - в горячих пламенах), в пламени окиси углерода - ОН и О. Вычисления скоростей процессов ОН Н2 Н2О Н и ОН СО СО2 Н из непосредственно измеренных концентраций гидроксила в зоне рассматриваемых пламен и известных констант скоростей этих процессов показывают, что их скорости близки к суммарной скорости соответствующих реакций. Отсюда следует, что эти процессы являются ведущими в реакциях горения водорода и окиси углерода, что вытекает также из химического механизма этих реакций. [29]
Как показали исследования, скорости протекания процессов горения в очень сильной степени зависят от интенсивности массо - и теплообмена. При тех высоких температурах и концентрациях, которые обычно имеют место в топочных камерах, сами химические реакции протекали бы с очень большими скоростями, если бы физические процессы тепло - и массообмена совершались с такими же или близкими к ним скоростями. В действительности же именно эти процессы совершаются несравненно медленней, и поэтому результирующая скорость всего процесса горения в целом определяется интенсивностью протекания процесса тепло - и массообмена. В связи с этим знание закономерностей этих процессов и методов их интенсификации приобретает особое значение. [30]
Страницы: 1 2 3