Сопряженная химическая реакция
Cтраница 3
Качественно с точки зрения химика-аналитика нужно знать лишь, что результаты для постояннотоковой полярографии легко можно экстраполировать на вольтамперометрию с линейной разверткой потенциала. Для простого случая переноса заряда графики зависимости ip от с получаются прямолинейными, а при наличии сопряженных химических реакций график зависимости ip от с часто получается криволинейным, как в случае каталитических процессов. [31]
Возможность варьирования условий протекания реакции особенно важна для неорганической электрохимии, так как позволяет исследовать эффекты сольватации и диссоциации. Возможность изменения кислотности растворителя или его склонности подвергаться ионным или свободнорадикальным превращениям может оказаться полезной при изучении сопряженных химических реакций, характерных для органических электрохимических процессов. [32]
В первую очередь среда влияет на реакции, сопряженные с переносом электронов. Поскольку скорость переноса заряда у органических соединений обычно высока, общая скорость электрохимического процесса чаще всего лимитируется скоростью сопряженной химической реакции. [33]
Предельный ток восстановления одинаков как при наличии, так и при отсутствии сопряженной химической реакции, поскольку он определяется скоростью доставки частиц А к электроду. Однако форма кривой изменяется; при наличии химической реакции система оказывается более медленной, чем простая система без сопряженной химической реакции. При окислении предельный гок определяется скоростью доставки частицы В ] к поверхности электрода. [34]
Кроме того, они могут служить моделью для применения с целью синтеза и получения незаменимых факторов, поскольку при помощи иммобилизованных ферментов и коферментов можно направленно осуществлять сопряженные химические реакции ( включая биосинтез незаменимых метаболитов), устраняя тем самым недостаток в веществах при наследственных пороках обмена. [35]
Несколько ранее полное описание этого метода было дано в гл. Когда за отдельной стадией переноса электрона следует химическая стадия, а предшествующей стадией является только диффузия в растворе, произведение it / не зависит от плотности тока, так же как в простом случае в отсутствие осложнений, связанных с протеканием сопряженных химических реакций. Переходное время % - это время, которое при плотности тока i необходимо для уменьшения концентрации электроактивных частиц на поверхности до нуля. Недавно опубликованный обзор по хронопотенциометрии [140] в основном посвящен этому вопросу. [36]
Какими бы ни были способы, посредством которых частицы, участвующие в электрохимических реакциях, достигают электрода, как бы ни происходили адсорбция, десорбция, деформация этих частиц на его поверхности, основной процесс, проте кающий на поверхности электрода, - это обмен электронами Следовательно, электрохимия прежде всего изучает окислительно восстановительные реакции. С этой точки зрения она представляла бы ограниченный интерес для химиков-органиков, если бы не исследовала более или менее сложные реакции, которые предшествуют, сопровождают или включаются между стадиями переноса заряда. Такие сопряженные химические реакции обусловливают огромное многообразие органических электрохимических реакций. [37]
Сначала целесообразно обсудить особенности строения слоя раствора, контактирующего с электродом, и вывести законы переноса заряда, обусловленных строением этого слоя. Необходимо учесть и влияние массопереноса Влияние сопряженных химических реакций можно пока не рассматривать. [38]
В разделах 7.3.3 и 7.3.4 рассматривались отклонения от обратимости электродных процессов, обусловленные замедленностью переноса заряда. Однако в некоторых типах систем могут преобладать кинетические эффекты, вызванные сопряженными химическими реакциями или адсорбцией, и часто отклонения от обратимости можно объяснить этими эффектами, а не замедленным переносом заряда. Работа [11] содержит прекрасный пример некоторых влияний сопряженных химических реакций на электродные процессы. В этой же работе подробно рассматриваются адсорбционные эффекты. [39]
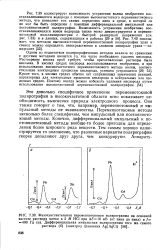 |
Фазочувствительная переменнотоковая полярограмма на основной. [40] |
Одним из недостатков полярографических методов анализа по сравнению с другими методами является то, что часто необходимо удалять кислород. Растворение многих проб требует, чтобы приготовленные растворы были кислыми. Кроме того, в кислых средах обычно нет сопряженных химических реакций, характерных для электродных процессов кислорода в нейтральных или щелочных средах. [41]
Таким образом, преимущества, связанные с ртутными электродами, могут быть использованы также и в хронопотенциомет-рии. Применение твердых или стационарных ртутных электродов в хронопотенциометрии, конечно, также чрезвычайно просто. С помощью хронопотенциометрии можно измерять скорости переноса электрона и сопряженных химических реакций, на несколько порядков более быстрые, чем методом постояннотоко-вой полярографии. [42]
Влияние среды на химические реакции, сопряженные с переносом заряда, легче продемонстрировать, чем влияние среды на перенос заряда. Например, при изменении среды скорости химических реакций MOiyT изменяться на несколько порядков. Поскольку скорость переноса заряда у органических соединений высока, общая скорость электрохимического процесса чаще всего лимитируется скоростью сопряженной химической реакции Вследствие очень большого влияния среды на кинетику химических реакций понятно, почему при изменении среды возможно полное изменение пути реакции. [43]
Величина осмотического давления пропорциональна числу частиц растворенного вещества в растворе, поэтому при наличии в растворе частиц различного размера ( в растворах полидисперсных веществ, например нефракционированного каучука) осмотические измерения дают среднюю величину молекулярного веса. Осмотические явления имеют место также в гелях, в ионообменных адсорбентах и в других системах в связи с ограниченной способностью коллоидных частиц к диффузии. В организмах осмотические явления играют важную роль в жизнедеятельности всех живых клеток, но в этом случае они осложняются сопряженными химическими реакциями в клетках, вследствие чего наблюдаемые распределения веществ; могут значительно отличаться от равновесных условий. [44]
Проще всего интерпретировать явления, которые не сопровождаются специфической адсорбцией индифферентного электролита, исходных веществ и продуктов реакции. Полностью такие идеальные условия никогда не соблюдаются, но в некотором приближении они реализуются для ряда процессов, протекающих на ртути значительно отрицательнее точки нулевого заряда. Специфической адсорбцией анионов на ртути в таких условиях можно пренебречь, а специфическая адсорбция многих катионов незначительна, и в этом случае легче установить количественную связь между кинетикой электродного процесса и структурой двойного слоя. Следует разобрать и более сложные случаи: влияние специфической адсорбции индифферентного электролита и адсорбции органической добавки ( незаряженной или ионной), а также электродные процессы с сопряженными химическими реакциями ( процессы, сопровождаемые хемосорбцие рассмотрены в гл. [45]
Страницы: 1 2 3