Значение - рана
Cтраница 1
Значения ран, полученные Рыбкиным и Шевченко [7] с применением различных поверхностно-активных веществ, сопоставлены на рис. 3.4 ( для разбавленных растворов НС1) и 3.5 ( для более высоких концентраций НС1), а также в табл. 3.17. Там же приведены, по данным [7], значения функции кислотности Я0, которая предложена в 1932 г. Хамметом в качестве меры кислотности растворов. Yin / Ymn от состава раствора; иначе говоря, предполагается, что при изменении состава раствора коэффициенты активности незаряженной и заряженной форм индикатора изменяются одинаково. На рис. 3.4 и 3.5 и в табл. 3.17 показана также концентрационная зависимость отрицательного логарифма реальной активности ионов водорода ( р н) в исследованных растворах НС1, не содержащих добавок поверхностно-активных веществ. [1]
Значения ран растворов НС1 при изменении температуры меняются совсем незначительно. Раствор с концентрацией 0 1 m имеет ран 1 09 ( см. табл. III. Значение рН для 0 1т раствора НС1, определяемое как - lg ( 0 lY), равно 1 2 при 275 С. [2]
Значения ран растворов НС1 при изменении температуры меняются совсем незначительно. Раствор с концентрацией 0 1 т имеет ран 1 09 ( см. табл. III.4) при температурах 0 - 50 С. Значение рН для 0 1т раствора НС1, определяемое как - lg ( 0 lY), равно 1 2 при 275 С. [3]
Значение ран разбавленного кислого раствора рассчитывается на основе резонного предположения, что коэффициент активности иона эквивалентен среднему коэффициенту активности кислоты при таких низких концентрациях. [4]
 |
Сопоставление значений рвц, рон и Я в волны растворах НС1 при 25 С. [5] |
Однако значения ран, полученные с применением поверхностно-активных кислот, при тнс. Ю-2 моль / кг заметно отличаются от остальных сравниваемых величин. Рыбкин и Шевченко объясняют это тем, что в достаточно разбавленных растворах хлороводород и добавляемые органические кислоты содержатся в сравнимых концентрациях, так что собственная диссоциация капроновой ( или энантовой) кислоты приводит к заметному возрастанию концентрации ионов Н и, следовательно, к повышению кислотности раствора. Между тем в сравнительно концентрированных растворах НС1 вклад капроновой или энантовой кислот в кислотность раствора пренебрежимо мал, поскольку их концентрация во много раз меньше концентрации НС1, а собственная диссоциация в этих условиях подавлена. Действительно, уже в умеренно концентрированных растворах ( mHCi Ю-2 моль / кг) значения ран, найденные с применением всех четырех поверхностно-активных веществ, удовлетворительно согласуются между собой. [6]
Однако такая согласованность значений ран, полученных на основе метода стабилизации поверхностного потенциала, с функцией Я0 наблюдается далеко не всегда. Для объяснения таких различий авторы [115] предположили, что адсорбционный слой на поверхности растворов НС1 состоит только из недиссоциированных молекул и при введении в раствор поверхностно-активных веществ, образующих поверхностный мономолекулярный слой, полностью экранируется. В растворах же НВг и НС1О4, помимо молекулярной адсорбции, имеет место специфическая адсорбция анионов ( Вг - или СЮТ) на свободной поверхности раствора. При введении в раствор поверхностно-активного вещества образуемый им молекулярный монослой эффективно экранирует только поле, создаваемое молекулярными диполями кислоты, но не в состоянии экранировать поле, образованное адсорбированными анионами. [7]
При температурах ниже 25 С значения ран по двум шкалам различаются на 0 001 ед. Значение стандартного потенциала также отражает изменения в стандартном состоянии и в шкале концентраций. В этой книге активности всюду будут основаны на шкале моляльности. [8]
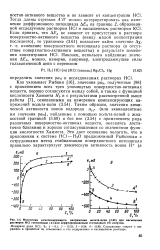 |
Изменения компенсирующего напряжения вольта-цепи при насыщении растворов НС1 гептиловым ( а или перфорированным гептиловым ( б спиртом. [9] |
Таким образом, значения химической активности ионов водорода ан ( или эквивалентные им значения ран), найденные с помощью вольта-цепей с жидкостной границей (3.60) и без нее (3.54) с применением ряда различных поверхностно-активных веществ, оказались достаточно близкими и хорошо согласующимися со значениями функции кислотности Хаммета. [10]
В соответствии с последним выводом стандартные растворы должны быть разбавленными, чтобы приписанные им значения ран с точностью до 0 01 ед. [11]
В оптимальных экспериментальных условиях инструментальное значение рН приближается к условному значению ра н, точно так же как в идеальных условиях в водных растворах инструментальное значение рН достигает значения ран. Это означает, что экспериментальное значение рН может полностью соответствовать константам диссоциации слабых электролитов, которые определяют кислотность раствора. [12]
Вероятно, более поразительным окажется контраст между влиянием изменения температуры на ран сильных кислот и ран сильных оснований. Действительно, когда значение ран возрастает сверх нейтральной точки, ионизация воды, имеющая большой тепловой эффект, приобретает важное значение в равновесии, которое определяет величину ран. Поэтому ран у щелочных растворов обычно падает с повышением температуры, а у кислотных растворов - возрастает. [13]
Кольтгофф и Томас [37] нашли возможным проводить измерения с водородным электродом в ацетонитриле и определили потенциал этого электрода относительно потенциала пары ферроцен - феррицинийпикрат. Кольтгофф и Чантони [90] также определили константы диссоциации в ацетонитриле и вычислили значения ран нескольких контрольных растворов, которые затем были использованы для стандартизации стеклянного электрода в этом растворителе. [14]
Электрометрически также была измерена константа диссоциации пикриновой кислоты и с ее помощью определено значение ран контрольного раствора пикриновой кислоты и пикрата тетрабутиламмония. [15]
Страницы: 1 2