Значение - сродство
Cтраница 2
В таблице 19 приведены значения сродства атома к электрону для элементов второго периода. [16]
С учетом сложностей прямого установления значений сродства к электрону уместно упомянуть о том, что полярографические потенциалы полуволны восстановления могут быть пропорциональны сродству к электрону. Так обстоит дело в апротон-ных растворителях, когда образующийся анион-радикал не подвергается дальнейшим изменениям и где полярографический процесс обратим. Однако установленные таким образом значения сродства к электрону включают и энергию сольватации образующегося иона. [17]
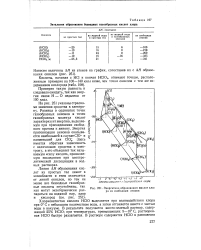 |
Энтальпии образования безводных газообразных кислот хлора. [18] |
На рис. 251 указаны стрелками значения сродства к электрону. Разница в ординатах точек газообразных анионов и точек газообразных молекул кислот характеризует энергию, выделяемую при присоединении свободного протона к аниону. Здесь имеется обратная зависимость с величинами сродства к электрону, а это объясняет так называемую силу кислот, проявляемую последними при электролитической диссоциации в водных растворах. [19]
Россини [ 24а ] и принять значения сродства к электрону, данные Бейли. [20]
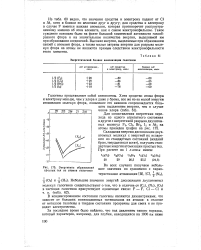 |
Энергетический баланс анионизации галогенов.| Энергетика образования простых тел из атомов галогенов. [21] |
Из табл. 60 видно, что значения сродства к электрону падают от CI к At, хотя и близки по величине друг к другу; для сродства к электрону в случае F имеется важная аномалия, которая противоречит распространенному мнению об этом элементе, как о самом электронофильном. Такое суждение основано было на факте большой химической активности газообразного фтора и на значительном количестве энергии, выделяемой им при образовании соединений. Высокие энергии, выделяемые при образовании связей с атомами фтора, а также малые затраты энергии для разрыва молекул фтора на атомы не являются прямым следствием электронофильности этого элемента. [22]
До сих пор таким способом были установлены значения сродства к электрону лишь для нескольких ароматических углеводородов ( см. табл. 11.1) и ряда их производных. Корреляция этих значений с найденными в рамках метода МОХ энергиями тех орбиталей, на которые попадают захватываемые тепловые электроны, выражена менее явно, нежели корреляции потенциалов ионизации с соответствующими орбитальными энергиями. [23]
Уравнениям, которые означают, что все значения сродства, соответствующие переходам каждой составляющей из одной фазы в другую, равны нулю. [24]
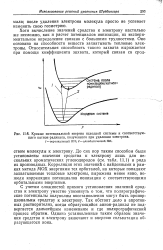 |
Кривые потенциальной энергии исходной системы и соответствующего катион-радикала, полученного при удалении электрона. 1 - вертикальный ПИ. 2-адиабатический ПИ. [25] |
До сих пор таким способом были установлены значения сродства к электрону лишь для нескольких ароматических углеводородов ( см. табл. 11.1) и ряда их производных. Корреляция этих значений с найденными в рамках метода МОХ энергиями тех орбиталей, на которые попадают захватываемые тепловые электроны, выражена менее явно, нежели корреляции потенциалов ионизации с соответствующими орбитальными энергиями. [26]
Для высших фуллеренов и их эндопроизводных приведены значения сродства к электрону и энергии ионизации. Эллипсоидальный углеродный каркас с системой тридцати и более сопряженных двойных связей уникален и по химическим свойствам существенно отличается от ароматических и непредельных углеводородов. Специфическое свойство, часто создающее труднопреодолимые препятствия для синтетиков, заключается в многовариантности реакций присоединения функциональных групп по двойным связям, что проявляется как в числе присоединенных функциональных групп, так и в их взаимном положении. Рассматриваются два метода селективного управляемого синтеза индивидуальных фторфуллеренов: прямое фторирование молекулярным фтором фуллерена в матрице дифторида марганца и твердофазовые реакции между фуллереном и фторирующим агентом. Рассмотрение ограничено малыми функциональными группами, что в большой степени снимает пространственные затруднения. Синтез в препаративных количествах индивидуальных фуллеренпроизводных, содержащих от двух до 48 малых функциональных групп и данные по этим соединениям, полученные методами масс спектрометрии, рентгенострукгурного анализа и яденого магнитного резонанса позволяют ответить на фундаментальные вопросы химии фуллеренов, а именно, какое число функциональных групп может быть размещено на углеродной сфере, содержащей 30 и более двойных связей, и какие из возможных соединений наиболее стабильны, каково взаимное положение присоединенных функциональных групп и какие искажения при этом претерпевает углеродная сфера. Динамика пространственной трансформации углеродной сферы и ее к-электронного облака по мере увеличения числа присоединенных функциональных групп тесно связана с образованием ароматических циклов, диеновых цепочек и изолированных двойных связей на углеродном каркасе. Приведены структуры трех индивидуальных соединений: СбоР18, СвоРго, СюР48, которые демонстрируют деформацию углеродного скелета в результате присоединения функциональных рупп. [27]
Суммы в последних членах правых частей выражают значения сродства реакции на границах мембраны х 0 и х а для проникающих в мембрану компонентов. [28]
Суммы в последних членах правых частей (2.78) выражают значения сродства реакции при х Ал: и х 0 для проникающих в систему ( в мембрану) компонентов. [29]
 |
Сродство к электрону атомов некоторых элементов. [30] |
Страницы: 1 2 3 4