Редлиха
Cтраница 1
Редлиха - Квонга; R - универсальная газовая постоянная; Л; - число мольных долей компонентов в смеси / - или -; ТКр. EI и d приведены в табл. 1.4 и 1.5; г - коэффициент сжимаемости. [1]
Редлиха - Кистера с ошибками в составе пара. Из него следует, что значение интеграла зависит не только от Ayt, но, в какой-то степени, и от характера равновесия в данной системе. [2]
Редлиха - Кистера и Ван-Несса. Оба метода одинаковы по термодинамической обоснованности, опираются на уравнение Гиббса-Дюгема, но между ними есть и довольно существенные различия, которые состоят в следующем. [3]
Редлиха и Кистера Авторы пришли к выводу, что наилучшее согласие с опытными данными дает метод Бенедикта. Однако рассмотрение результатов их расчетов показывает, что разница между данными, полученными по различным методам, столь невелика, что основания для такого вывода кажутся спорными. Разумеется, произведенное сопоставление на примере одной системы не позволяет дать сколько-нибудь полную сравнительную оценку различных методов расчета коэффициентов активности. [4]
Редлиха - Кистера, Chen и Kyle [120] - уравнения Ван-Лаара и Маргулеса, Ренон и Праузниц [118] - уравнения NRTL. [5]
Редлиха и Кистера, предлагают новый вариант метода термодинамической проверки экспериментальных данных о равновесии жидкость-пар в бинарных системах. Сущность метода состоит в том, что качество данных определяется путем сопоставления величин логарифмов коэффициентов активности, найденных непосредственно по экспериментальным данным и рассчитанных интегрированием уравнения Гиббса-Дюгема. [6]
Редлиха - Квонга и Бенедикта - Вебба - Рубина. Некоторые такие работы заслуживают особого упоминания как отражающие методы общего характера. Эдмистер, Томпсон и Ярборо [48] использовали выражение ( VI. Редлиха - Квонга для определения коэффициентов футитйв-ности смесей. Результирующие выражения, полученные в этой работе, громоздки и могут быть использованы только при расчетах на ЭМВ. [7]
Редлиха - Квонга или модифицированным уравнением Ван-дер - Ваальса - или же следует использовать какое-либо другое наименование. Поскольку этот вопрос не играет важной роли и поскольку самолюбие Редлиха задето уже не будет ( в 1978 г. он умер), мы будем использовать различные наименования данного уравнения в зависимости от характера проведенной модификации. [8]
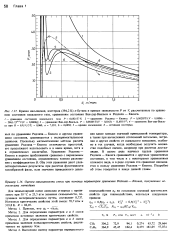 |
Кривая насыщения, изотерма ( 394 2 К н-бутана и кривые зависимости Р от У, рассчитанные по уравнению состояния идеального газа, уравнениям состояния Ван-дер - Ваальса и Редлиха - Квонга. [9] |
Редлиха - Квонга и другим уравнениям состояния, сравниваются с экспериментальными данными. Поскольку математические методы расчета уравнения Редлиха - Квонга отличаются простотой, его продолжают использовать и в наше время, хотя и в ограниченных масштабах. Уравнение Редлиха - Квонга в первом приближении сравнимо с вириальным уравнением состояния, ограниченным членом разложения с коэффициентом В. [10]
Редлиха - Квонга для описания фазового равновесия в условиях высокого давления. [11]
Редлиха - Квонга и пренебрегите изменением энтальпии смешения. [12]
Редлиха - Квонга или модифицированным уравнением Ван-дер - Ваальса - или же следует использовать какое-либо другое наименование. Поскольку этот вопрос не играет важной роли и поскольку самолюбие Редлиха задето уже не будет ( в 1978 г. он умер), мы будем использовать различные наименования данного уравнения в зависимости от характера проведенной модификации. [13]
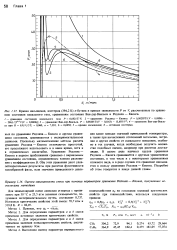 |
Кривая насыщения, изотерма ( 394 2 К н-бутана и кривые зависимости Р от У, рассчитанные по уравнению состояния идеального газа, уравнениям состояния Ван-дер - Ваальса и Редлиха - Квонга. [14] |
Редлиха - Квонга и другим уравнениям состояния, сравниваются с экспериментальными данными. Поскольку математические методы расчета уравнения Редлиха - Квонга отличаются простотой, его продолжают использовать и в наше время, хотя и в ограниченных масштабах. Уравнение Редлиха - Квонга в первом приближении сравнимо с вириальным уравнением состояния, ограниченным членом разложения с коэффициентом В. [15]
Страницы: 1 2 3 4