Редлиха
Cтраница 2
Редлиха - Квонга для описания фазового равновесия в условиях высокого давления. [16]
Редлиха - Квонга и пренебрегите изменением энтальпии смешения. [17]
Редлиха - Квонга или модифицированным уравнением Ван-дер - Ваальса - или же следует использовать какое-либо другое наименование. Поскольку этот вопрос не играет важной роли и поскольку самолюбие Редлиха задето уже не будет ( в 1978 г. он умер), мы будем использовать различные наименования данного уравнения в зависимости от характера проведенной модификации. [18]
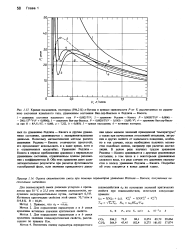 |
Кривая насыщения, изотерма ( 394 2 К н-бутана и кривые зависимости Р от V, рассчитанные по уравнению состояния идеального газа, уравнениям состояния Ван-дер - Ваальса и Редлиха - Квонга. [19] |
Редлиха - Квонга и другим уравнениям состояния, сравниваются с экспериментальными данными. Поскольку математические методы расчета уравнения Редлиха - Квонга отличаются простотой, его продолжают использовать и в наше время, хотя и в ограниченных масштабах. Уравнение Редлиха - Квонга в первом приближении сравнимо с вириальным уравнением состояния, ограниченным членом разложения с коэффициентом В. [20]
Редлиха - Квонга для описания фазового равновесия в условиях высокого давления. [21]
Редлиха - Квонга и пренебрегите изменением энтальпии смешения. [22]
Редлиха и Кистера, предлагают новый вариант метода термодинамической проверки экспериментальных данных о равновесии жидкость-пар в бинарных системах. Сущность метода состоит в том, что качество данных определяется путем сопоставления величин логарифмов коэффициентов, активности, найденных непосредственно по экспериментальным данным и рассчитанных интегрированием уравнения Гиббса-Дюгема. [23]
Мар-гулеса и Редлиха и Кистера с двумя или тремя константами для бинарных систем. [24]
Ван-Лаара, Редлиха - Кистера и др., приводит к необходимости находить значительное число опытных параметров, отвечающих этим уравнениям, что, однако, не дает возможности делать обобщения в случае многокомпонентных систем. Вместе с тем применение таких известных моделей, как уравнения Вильсона и NRTL, позволяет уже без особых затруднений делать подобные обобщения, поскольку в указанных уравнениях заложен определенный механизм анализируемой подсистемы, позволяющий рассматривать описываемое явление с помощью независимых эффектов парных взаимодействий. [25]
Ван-Лаара, Редлиха - Кистера) это уравнение отличается тем, что для определения его параметров необходимы лишь бинарные равновесные данные. Применимость этого уравнения для описания неидеальности жидких фаз многократно доказана и общеизвестна. [26]
Мар-гулеса и Редлиха и Кистера с двумя или тремя константами для бинарных систем. [27]
Обобщения уравнений Маргулеса и Редлиха - Кистера на случай многокомпонентных систем [206] содержат, наряду с бинарными параметрами, параметры, оцениваемые по данным для многокомпонентной системы. Хотя этими дополнительными параметрами часто пренебрегают, неспособность теоретически обоснованно описать свойства многокомпонентного раствора по данным только для бинарных систем - наиболее существенный недостаток полиномиальных уравнений. [28]
Аппроксимирующие уравнения Воля, Редлиха - Кистера и др. имеют ряд недостатков: наличие членов, учитывающих поликомпонентные взаимодействия, известная неопределенность в необходимом числе коэффициентов. В отличие от них уравнение Вильсона базируется только на бинарных данных и может применяться для любых многокомпонентных систем. Это уравнение явилось первой зависимостью, использующей представления о локальной концентрации, которые связаны с определенной физической моделью раствора. [29]
Правило произведений Тел-лера - Редлиха. [30]
Страницы: 1 2 3 4