Редоксипотенциал
Cтраница 2
В предыдущих главах этот вопрос частично уже был затронут при рассмотрении влияния протолиза на комплексообразование, а также при рассмотрении влияния протолиза и комплексообразования на редоксипо-тенциал. Однако еще не рассмотрено влияние комплексообразования и редоксипотенциала на протолиз растворенных веществ, а также влияние редоксипотенциала раствора на комплексообразование. [16]
Значение измеренной ЭДС показывает разницу между потенциалами металлических фаз исследуемого и стандартного электродов. Эту разницу принято называть электродным потенциалом или редоксипотенциалом. [17]
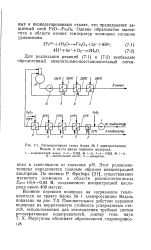 |
Регенеративная схема блока № 1 электростанции Ведель и места ввода перекиси водорода. [18] |
Этот редоксипо-тенциал определяется главным образом концентрацией кислорода. Фрайера [21], существование магнетита возможно в области редоксипотенциала EQ - 0 4 - 0 43 В, создаваемого концентрацией кислорода около 400 мкг / кг. [19]
В предыдущих главах этот вопрос частично уже был затронут при рассмотрении влияния протолиза на комплексообразование, а также при рассмотрении влияния протолиза и комплексообразования на редоксипо-тенциал. Однако еще не рассмотрено влияние комплексообразования и редоксипотенциала на протолиз растворенных веществ, а также влияние редоксипотенциала раствора на комплексообразование. [20]
Измерения потенциала осуществляют при конечных изменениях активностей ( концентраций) отдельных форм редоксипары. Совпадение измеренного редоксипотенциала с вычисленным по формуле Нернста указывает на термодинамическую обратимость данной редоксипары. [21]
В качестве примера полиферментной системы, осуществляющей фотосинтетическую реакцию, можно привести систему, которая образует сахарозу из СО2 и воды. Цепь реакций связана с присутствием АТФ и НАДФ-Н2, которые поставляются за счет фотохимических превращений, связанных с поглощением световой энергии. Здесь участвуют хлорофилл и ферредоксин - железопротеид с исключительно высоким редоксипотенциалом. Частица СО2 присоединяется к центру молекулы риболезодифос-фата; полученное соединение затем распадается ( с внутримолекулярным переносом водорода) на две молекулы фосфоглицера-та, а это вещество в обратном порядке проходит весь тот путь, при котором оно образуется при обычном гликолизе. [22]
Элементарные объекты растворенных веществ могут в растворе подвергаться протолизу, окислению или восстановлению, а также вступать в реакции комплексообразования. Зачастую одновременно действуют несколько из этих факторов, и состояние растворенных веществ зависит от суммарного их воздействия. В предыдущих главах этот вопрос частично уже был затронут при рассмотрении влияния протолиза на комплексообразование, а также влияния протолиза и комплексообразования на редоксипотенциал. Однако еще не рассмотрено влияние комплексообразования и редоксипотенциала на протолиз растворенных веществ, а также влияние редоксипотенциала на комплексообразование. [23]
Элементарные объекты растворенных веществ могут в растворе подвергаться протолизу, окислению или восстановлению, а также вступать в реакции комплексообразования. Зачастую одновременно действуют несколько из этих факторов, и состояние растворенных веществ зависит от суммарного их воздействия. В предыдущих главах этот вопрос частично уже был затронут при рассмотрении влияния протолиза на комплексообразование, а также влияния протолиза и комплексообразования на редоксипотенциал. Однако еще не рассмотрено влияние комплексообразования и редоксипотенциала на протолиз растворенных веществ, а также влияние редоксипотенциала на комплексообразование. [24]
Изменения ионной силы раствора вызывают изменения коэффициентов активности ионов. Зарядность окисленной формы обычно отличается от зарядности восстановленной формы, поэтому их активности изменяются в различной степени. Если при этом отношение активностей в формуле Нернста увеличивается, редоксипотенциал возрастает, и наоборот. [25]
Элементарные объекты растворенных веществ могут в растворе подвергаться протолизу, окислению или восстановлению, а также вступать в реакции комплексообразования. Зачастую одновременно действуют несколько из этих факторов, и состояние растворенных веществ зависит от суммарного их воздействия. В предыдущих главах этот вопрос частично уже был затронут при рассмотрении влияния протолиза на комплексообразование, а также влияния протолиза и комплексообразования на редоксипотенциал. Однако еще не рассмотрено влияние комплексообразования и редоксипотенциала на протолиз растворенных веществ, а также влияние редоксипотенциала на комплексообразование. [26]
Страницы: 1 2