Значение - теплота - адсорбция
Cтраница 4
Микроскопические участки с различными значениями теплоты адсорбции и энергии активации расположены на поверхности твердого вещества хаотически, но при течении адсорбционного или каталитического процесса на этой поверхности они участвуют в процессе группами с одинаковым ( или почти одинаковым) значением теплоты адсорбции или энергии активации. [46]
В некоторых статьях и монографиях, например в [50, 155, 374, 424], закономерности реального адсорбированного слоя, в частности логарифмическую изотерму адсорбции, трактуют с точки зрения аппроксимации уравнения изотермы адсорбции Лэнгмюра. В это уравнение подставляют значения теплот адсорбции как функции заполнения поверхности и полагают, что такие зависимости приближенно выражают наблюдаемые на опыте. В свете изложенного, следует отметить, что такая интерпретация не обоснована, поскольку в уравнение, справедливое для идеального адсорбированного слоя, подставляются зависимости, характерные для реального адсорбированного слоя, когда исходное уравнение уже не может быть применено. [47]
Сведения о величинах теплот адсорбции реагирующих веществ, продуктов реакции и промежуточных продуктов гетерогенной каталитической реакции позволяют выяснить природу активности катализатора. Если для данных веществ значения теплот адсорбции Q ( - АН) очень велики, то ясно, что каталитическое превращение будет полностью подавлено, потому что эти вещества слишком прочно удерживаются поверхностью. С другой стороны, если Q очень мало, то рассматриваемые вещества, возможно, не будут адсорбироваться на поверхности катализатора на время, достаточное чтобы облегчить каталитическую реакцию ( см. разд. Очевидно, необходимым условием эффективного катализа является такое положение, когда теплота адсорбции не слишком велика, чтобы затруднять десорбцию, и не слишком мала, чтобы препятствовать молекулярным перестройкам в адсорбированной фазе. Следовательно, очень важно знать величину теплоты адсорбции. [48]
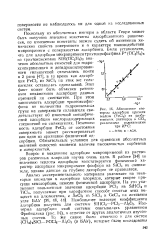 |
В. Абсолютные изотермы адсорбции примеси ( FeClg из pa. s6a - расттюров и СС14 различными силикагелями. [49] |
Вопрос о механизме адсорбции микропримесей из растворов различных хлоридов изучен очень мало. В работе [34] по значению теплоты адсорбции констатируется физический характер адсорбции микроприме-си фосфора из SiCl4 па силика-гсле, однако данные но глубине десорбции не приводятся. [50]
Если воду все время удалять, то энергия активации уменьшится на 13 - 16 ккал. Это значение близко к значению теплоты адсорбции ( или десорбции) водяного пара. Аналогичные результаты были получены также и в других случаях. [51]
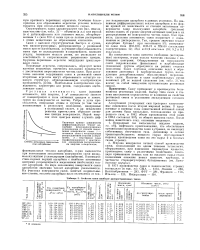 |
Сиойства сажи наиболее распространенных типов. [52] |
Взаимодействие первых порций адсорбата с наиболее активными центрами сопровождается выделением наибольших теплот адсорбции. По мере заполнения поверхности сажи адсорбатом значения теплот адсорбции уменьшаются. [53]
Теплоты адсорбции некоторых газов для ряда катализаторов даны в табл. VI. Для реакций окисления на оксидных катализаторах значения теплот адсорбции кислорода без больших искажений можно заменять на более полно табулированные значения теплот образования оксидов или энергии связи в них металл-кислород. [54]
Для более широкопористых адсорбентов наблюдается линейная зависимость дифференциальной теплоты адсорбции от числа атомов углерода в молекуле. В работе [79] установлено, однако, что значения теплоты адсорбции ряда насыщенных углеводородов и бензола па силикагеле при малых заполнениях меньше значений теплот адсорбции, определенных при тех же заполнениях в калориметре ( см. стр. [55]
Страницы: 1 2 3 4