Значение - теплота - гидратация
Cтраница 1
Значения теплот гидратации для некоторых ионов приведены в Приложении 1 данной главы. [1]
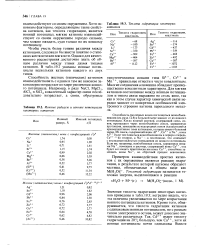 |
Ионные радиусы и ионные потенциалы некоторых катионов.| Теплота гидратации некоторых катионов. [2] |
Значения теплоты гидратации некоторых катионов приведены в табл. 19.3; нетрудно видеть, что эта величина увеличивается по мере возрастания ионного потенциала катионов. Кроме того, обнаруживается, что теплота гидратации катионов с одинаковым ионным потенциалом, но с разным типом электронного остова, может довольно значительно различаться. [3]
Значения теплот гидратации ионов, необходимые для расчета по уравнению (2.65), находим из справочных данных. [4]
Значения теплот гидратации ионов взяты из таблицы Быховского и Россини [134] и подсчитаны по отношению к приравниваемой нулю теплоте образования иона водорода воды. Указанное обстоятельство не будет препятствовать использованию этих величин для наших целей в связи с другими термодинамическими данными, так как в каждом уравнении имеется по одной такой величине. II и III более вероятны, чем реакция I); далее, они показывают, что в щелочных растворах присоединение будет протекать легче, чем в кислотных растворах. Интересно отметить, что, в то время как английская теория, выводя электрофильный характер альдегида, исходит из стремления положительно заряженного углеродного атома карбонила образовывать ковалентные связи, приведенное выше рассуждение рассматривает гидратацию водородного иона как решающий фактор. [5]
 |
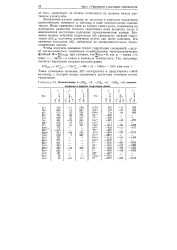
Теплоты гидратации отдельных ионов ( кДж / моль и числа гидратации h. [6] |
Значения теплот гидратации ряда ионов, вычисленные упомянутыми способами на основании теоретических моделей и опытных данных, приведены в табл. 10.3. Как видно, в общем наблюдается некоторое соответствие, однако в отдельных случаях расхождение велико. Это связано с несовершенством теоретических представлений, используемых для расчетов. [7]
 |
Относительные ( - Д н - Н 0. - н 0 теплоты, энтропии и энергии гидратации ионов. [8] |
Чтобы получить значения теплот гидратации соединений, следует воспользоваться линейными комбинациями термодинамических функций D22 V XL при условии, что22: гУг 0, где jz - - заряд г - го иона; Vj - число г-х ионов в молекуле электролита. [9]
В таблицах приводятся значения теплот гидратации для 91 иона; из этого числа для 68 ионов теплоты гидратации вычисляются нами впервые. Обращает на себя внимание то обстоятельство, что теплоты гидратации ионов, вычисленные независимо от нас Мищенко [83], хорошо совпадают с полученными нами значениями. [10]
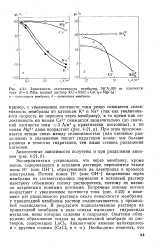 |
Зависимость селективности мембраны МГА-100 от плотности тока ( Р3 МПа, водный раствор KCl NaCl CaCl2 MgCl2. а - прикатодная мембрана. б - прианодная мембрана. [11] |
При этом прослеживается четкая связь между селективностью ( или степенью разделения) и значениями теплот гидратации ионов: чем больше разница в теплотах гидратации, тем выше степень разделения катионов. [12]
Следует учесть, что значения АЯЙ, вычисленные по уравнению ( 27), являются приближенными, так как уравнение Борна основано на простой электростатической модели, в которой ион находится в сплошной среде с постоянной диэлектрической проницаемостью, тогда как в действительности необходимо учитывать истинную молекулярную структуру среды. Тем не менее значения теплот гидратации комплексных ионов и лигандов, вычисленные по уравнению ( 27), можно использовать для выявления закономерностей в энергиях гидратации или величинах А / / / [ уравнение ( 18) ] для рядов ионов металлов. Таким образом, теплоты гидратации хорошо известны для ионов металлов, сравнительно мало изучены для лигандов и почти неизвестны для большинства комплексов металлов. Важно помнить, что все значения энергии гидратации, определенные экспериментально, выражены в относительной шкале, где тепловой эффект водородного полуэлемента [ уравнение ( 23) ] принят равным нулю. [13]
После ознакомления с основными методами расчета, применяемыми при изучении энергетики процесса гидратации, интересно сопоставить результаты, полученные при помощи этих методов. Такое сопоставление позволяет судить, во-первых, о величинах теплот и энергий гидратации, и, во-вторых, о том, насколько результаты различных авторов согласуются между собой. В табл. 14 приведены значения теплот гидратации и в табл. 15 - значения энергий гидратации. Наряду с данными, полученными по описанным ранее методам, включены также результаты расчетов другими методами. В методе Фаянса используются циклы, связанные с применением водородного и амальгамного калиевого электродов и рассчитываются соответственно теплоты гидратации протона и иона калия. [14]
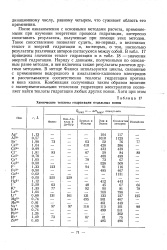 |
Химические теплоты гидратации отдельных ионов. [15] |
Страницы: 1 2