Значение - стерический фактор
Cтраница 2
ЛеНХотя подобные идеи высказывались и некоторым г другими исследователями ( см., например, Kistiakowsky, 1936), общее Качение этой новой области стереохимии было понято не сразу паже после интересной заметки Бэддли ( Baddeley, 1939), который показал значение стерических факторов для понимания широкого круга физических и химических свойств сопряженных систем, имеющих различные типы сопряжения. [16]
Значение стерического фактора сильно сказывается на скорости реакций, протекающих с участием сложных молекул, например белков, где велико общее число способов ориентации и жесткие условия для благоприятных ориентации. [17]
Этот результат показывает также, что значение стерического фактора в данном случае действительно не отличается от единицы, как это было принято при расчетах. [18]
С другой стороны, был произведен расчет констант равновесия радикальных реакций кинетическим методом, по отношению вычисленных констант скоростей прямой и обратной реакций. В свою очередь константы скорости прямой и обратной радикальных реакций были вычислены по значениям стерических факторов и энергий активации радикальных реакций. Энергии активации радикальных реакций были оценены на основании полуэмпирического уравнения Пола-ни - Семенова, которое позволяет вычислить энергию активации по величинам тепловых эффектов радикальных реакций. [19]
Стекла составов GeSe4, GeSes и GeSee характеризуются устойчивой электропроводностью, заметно не меняющейся после 3-часового отжига при 200 С, а также при изменении режима синтеза и охлаждения. Энергия активации электропроводности для этих стекол примерно одинакова и составляет еа 2 2 эв, значение стерического фактора Igp свидетельствует о сквозной проводимости. [20]
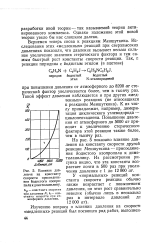 |
Влияние давления на константу скорости присоединения йодистого изопропила к диметиланилину. [21] |
Вернемся теперь снова к реакциям Меншуткина. Исследования этих медленных реакций при сверхвысоких давлениях показали, что давление вызывает весьма сильное увеличение значения стерического фактора и тем самым быстрый рост константы скорости реакции. [22]
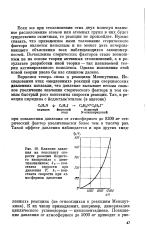 |
Влияние давления на константу скорости реакции йодистого изопропила с диме-тиланплином. kp - константа скорости прп давления Р. k - константа скорости при атмосферном давлении. [23] |
Вернемся теперь снова к реакциям Меяшуткина. Исследования этих медленных реакций при сверхвысоких давлениях показали, что давление вызывает весьма сильное увеличение значения стерического фактора и тем самым быстрый рост константы скорости реакции. [24]
 |
Некоторые возможные положения молекулы азога при физической адсорбции на поверхностях монокристалла меди ( по Родину. [25] |
Если предположить, что в действительности шероховатость различных кристаллических граней приблизительно одинакова, то из сказанного можно опять-таки сделать вывод, что упаковка более эффективна на наименее плотной грани и что наблюдаемые более высокие значения коэффициента шероховатости являются только кажущимися. В настоящее время более подробное обсуждение описанных явлений нецелесообразно, пока не будут получены новые данные относительно значения стерических факторов в процессах адсорбции на поверхностях монокристаллов. [26]
В молекулярных реакциях второго порядка стерические факторы также принимаются равными единице. Тем самым молекулярные реакции наделяются привилегиями по сравнению с реакциями замещения радикалов или их присоединения к непредельным молекулам, обладающими низкими; значениями стерических факторов. В таком случае представление о различии стерических факторов молекулярных и радикальных реакций является необоснованным и ведет к тому, что действительные конкурентные отношения1 между молекулярными и радикальными реакциями предстают в искаженном виде. При этом отличие, создаваемое ие-кусственным представлением о различии стерических факторов на несколько порядков ( 2 - 3), способно в значительной степени стушевать большую разность энергий активации молекулярной и радикальной реакций. [27]
В реакциях Н и СН3 - радикалов с предельными молекула-ми, согласно результатам вычислений, наблюдается ан ло-гичная картина. Стерические факторы реакций Н - атомов с алканами по порядку величины заключены между Ю-3-10-2, но обратные реакции сложных алкил-радикалов с молекулами водорода имеют значения стерических факторов на два - три порядка меньше. Замена Н - атомов радикалами СН3 в аналогичных реакциях ведет также к резкому снижению стерических факторов на два-три порядка по тем же причинам, которые указывались для реакций с алкенами. Обратные реакции сложных алкильных радикалов с молекулой метана имеют стерические факторы того же порядка величины, что и в прямых реакциях. [28]
Если принять этот результат и значения AS и АЯ реакции (6.1), которые можно определить из данных табл. 1.2, то для величины & рек найдем значение, меньшее z0: speK Лрек / г0 10-а. Такие же значения стерических факторов в реакциях рекомбинации радикалов - СН3 - СН3 и - СН3 - С2Н5 получены Бродским, Калиненко, Лавмовским и Титовым [135] при экспериментальном изучении кинетики высокотемпературного крекинга этана. [29]
Некоторые карбонильные соединения, электрофильный характер которых выражен довольно слабо, не реагируют со стабильными илидами типа флуоренилидентрифенилфосфорана. С другой стороны, более нуклеофильный флуоренилидентри-н-бутилфос-форан реагирует с кетонами типа n - нитроацетофенона. Пока не ясно значение стерических факторов для реакционной способности карбонильных соединений. [30]
Страницы: 1 2 3