Значение - энергия - решетка
Cтраница 2
Борн показал, как можно сопоставить теоретические ( рассчитанные) значения энергии решетки с экспериментальными данными. Наконец, при образовании хлорида натрия из металлического натрия и газообразного хлора выделится энергия, равная теплоте образования 1 моля хлорида натрия. [16]
Ниже, в табл. 25, мы приводим вычисленные по уравнению ( 43) значения энергии решетки для 31 соли, теплоты образования которых неизвестны. [17]
Некоторые из этих галогенидов получены, другие не получены, а существование третьих, например CuF ( о получении которых есть сведения в литературе), сомнительно. Рассчитанные таким образом значения энергии решетки объединяются с другими данными в цикле Борна - Габера [ уравнение (3.12) ], и это позволяет рассчитать теплоты образования кристаллических галогенидов ( ср. Результаты расчетов Линнетта для известных галогенидов очень хорошо согласуются с экспериментально установленными теплотами образования. Они показывают, что неизвестные соединения 5сВг2, Sch и NiFs можно получить. [18]
Энтальпия образования ионного соединения может быть рассчитана с использованием уравнения Борна - Ланде (3.9) и цикла Борна - Габера. По уравнению (3.9) было получено значение энергии решетки UQ - 755 2 кДж / моль; с учетом поправки на теплоемкость ( - 2 1 кДж / моль) окончательное значение составит t / 0 298 - - 757 3 кДж / моль. [19]
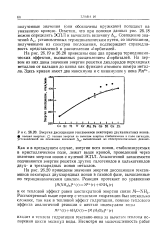 |
Энергия диссоциации гексамминов некоторых двухвалентных ионов. [20] |
На рис. 26.19 и 26.20 приведены еще два примера термодинамических эффектов, вызванных расщеплением d - орбиталей. На первом из них даны значения энергии решетки дихлоридов переходных металлов от кальция до цинка как функция атомного номера металла. [21]
Результаты вычислений отдельных эффектов для ионов щелочных металлов и галогенов приведены в табл. IV.6. Как уже указывалось ( стр. При этом следует помнить, что последние не могут быть определены прямым путем и содержат значительные погрешности: уже суммарные теплоты гидратации ДЯ отягчены ошибками в значениях энергий решеток, а разделение АЯ между отдельными ионами вносит добавочную неопределенность. [22]
Зная суммарную теплоту сольватации в данном растворителе хотя бы для одной соли, можно, пользуясь найденными разностями для катионов и анионов, ориентировочно предсказать A / / J для ряда других электролитов. Если при этом энергия решетки избранной соли известна с достаточной достоверностью, то при вычислениях элиминируются менее надежные энергии решеток других солен. Выше мы указывали, какой разнобой в значениях энергии решетки, например, иодида натрия имеется в литературе. [23]
Зная суммарную теплоту сольватации в данном растворителе хотя бы для одной соли, можно, пользуясь найденными разностями для катионов и анионов, ориентировочно предсказать ЛЯ. Если при этом энергия решетки избранной соли известна с достаточной достоверностью, то при вычислениях элиминируются менее надежные энергии решеток других солей. Выше мы указывали, какой разнобой в значениях энергии решетки, например, иодида натрия имеется в литературе. [24]
Для таких хлоридов, как CaCla и BaClz, энергия решетки вычисляется равной соответственно 528 и 474 ккал. Для теплоты образования вычисляются значения 96 ккал / г-экв и 102 ккал / г-экв, которые находятся в хорошем согласии с опытными термохимическими данными. Однако, если мы будем таким же образом рассчитывать значения энергии решетки для солей, образованных из ионов иеблагородногазовой структуры, то для Q получаются значения, сильно расходящиеся с опытом, причем степень отклонения может в некоторой мере служить мерилом отступления от ионной связи. [25]
Для таких хлоридов, как СаСЬ и BaCla, энергия решетки вычисляется равной соответственно 528 и 474 ккал. Для теплоты образования вычисляются значения 96 ккал / г-экв и 102 ккал / г-экв, которые находятся в хорошем согласии с опытными термохимическими данными. Однако, если мы будем таким же образом рассчитывать значения энергии решетки для солей, образованных из ионов ыеблагородногазовой структуры, то для Q получаются значения, сильно расходящиеся с опытом, причем степень отклонения может в некоторой мере служить мерилом отступления от ионной связи. [26]
Обычно такие реакции изучают в газовой фазе по изменению давления паров. При этом теплота образования аддукта является хорошим критерием основности. Однако, если одно из соединений осаждается из газовой фазы, результаты будут включать значения энергий решетки или теплот испарения и будут бессмысленными или неправильными. Другое препятствие для изучения равновесия в газовой фазе по методу давления паров заключается в том, что образование комплекса может быть либо слишком полным для того, чтобы его измерять, либо необнаружимо малым. В некотором смысле это соответствует эффекту выравнивания. [27]
В табл. 10 сведены результаты вычислений отдельных эффектов для ионов щелочных металлов и галогенов. При этом следует помнить, что последние не могут быть определены прямым путем и содержат значительные погрешности: уже суммарные теплоты гидратации А / /, отягчены ошибками в значениях энергий решеток, а разделение А. [28]
Известно, что при растворении полярных веществ, главным образом солей, выделяется или поглощается ( обычно в малых количествах) энергия, так называемая теплота растворения. Эта энергия, измеряемая в виде тепла, является разностью двух противоположных и больших энергетических эффектов. С одной стороны, расходуется энергия на вырывание ионов из кристаллической решетки соли и для сообщения этим ионам поступательной кинетической энергии в растворе; с другой стороны, выделяется энергия при сольватации ионов в результате притяжения вокруг каждого иона слоя молекул растворителя. Эти молекулы связаны с ионами ионодипольными силами. В зависимости от того, какой из эффектов преобладает, растворение сопровождается ( обычно слабым) экзотермическим или эндотермическим эффектом. Во многих случаях безводные соли растворяются с выделением, а их гидраты - с поглощением тепла, что само собой попятно. Значения энергий решеток и энергий сольватации в случае ионных соединений, как правило, очень велики. Так, растворение хлористого натрия является почти термонейтральным процессом ( 1 2 кк. Однако энергия решетки хлористого натрия равна 183 ккал / моль, таким образом, энергия сольватации ионов Na и СГ -, компенсирующая почти всю эту энергию, равна - 180 ккал / моль. Эта энергия сольватации играет очень большую роль в реакциях, в которых появляются ионные промежуточные продукты. [29]
Известно, что при растворении полярных веществ, главным образом солей, выделяется или поглощается ( обычно в малых количествах) энергия, так называемая теплота растворения. Эта энергия, измеряемая в виде тепла, является разностью двух противоположных и больших энергетических эффектов. С одной стороны, расходуется энергия на вырывание ионов из кристаллической решетки соли и для сообщения этим ионам поступательной кинетической энергии в растворе; с другой стороны, выделяется энергия при сольватации ионов в результате притяжения вокруг каждого иона слоя молекул растворителя. Эти молекулы связаны с ионами ионодипольными силами. В зависимости от того, какой из эффектов преобладает, растворение сопровождается ( обычно слабым) экзотермическим или эндотермическим эффектом. Во многих случаях безводные соли растворяются с выделением, а их гидраты - с поглощением тепла, что само собой понятно. Значения энергий решеток и энергий сольватации в случае ионных соединений, как правило, очень велики. Однако энергия решетки хлористого натрия равна 183 ккал / мо. Na и С1 -, компенсирующая почти всю эту энергию, равна - 180 ккал / молъ. Эта энергия сольватации играет очень большую роль в реакциях, в которых появляются ионные промежуточные продукты. [30]
Страницы: 1 2 3