Значение - энергия - активация
Cтраница 2
Значение энергии активации, конечно, зависит от Z2 / A. При Z2 / A 45 энергия активации обращается в нуль. [16]
 |
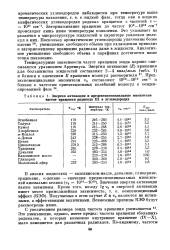
Энергия активации реакции регенерации. [17] |
Значения энергии активации для процесса окисления за-коксованных частиц катализатора имеют широкий диапазон изменения, как показано в табл. 9.1. Очень низкие значения, вероятно, вызваны диффузионными ограничениями и поэтому не являются истинными значениями энергии активации. Представляется, что значение энергии активации 150 кДж / моль соответствует константе скорости для окисления углерода. [18]
Значения энергии активации для реакций, сопоставленных в табл. 43, располагаются между 24 и 28 ккал / моль. [19]
Значения энергии активации для реакций, сопоставленных в табл. 43, располагаются между 24 и 28 ккал / молъ. [20]
Значение энергии активации 52 7 - 65 5 ккал / молъ, характерное для реакции СОг С [13, 35], позволяет предположить, что при степени восстановления окисла 70 % ( при стехиометрическом количестве и избытке углерода) она более медленная, определяющая процесс реакция. [21]
Значение энергии активации для промышленных катализаторов в интервале температур 400 - 500 С при технологических расчетах принимают равным 167 5 кДж / моль. [22]
 |
Энергия активации и предэкспоненциальные множители частот вращения радикала III в углеводородах. [23] |
Значения энергии активации также завышены. Получаемые в этом случае Е и v0 являются не истинными, а эффективными величинами. Возможные причины КЭФ будут рассмотрены ниже. [24]
Значение энергии активации легко определить на основании уравнения (2.47) по тангенсу угла наклона прямой ln / t - T - l, равному - E / R. Для по-давляющего большинства процессов энергия активации лежит в пределах от 50 до 250 кДж / моль, лишь для реакций с участием атомов и радикалов ( в соответствии с большей их реакционной способностью) она меньше 50 кДж / моль и может составлять даже несколько кДж / моль, а для взаимодействия ионов близка к нулю. [25]
Значение энергии активации, определенное для бимолекулярных реакций экспериментально, как правило, совпадает с расчетным. В приложении приведены значения энергий активации для некоторых реакций. [26]
Значения энергии активации, определенные таким образом, оказываются в пределах 12 - 17 кДж / моль, что совпадает со значениями энергии активации вязкого течения жидкости. Такое совпадение энергий активации двух процессов говорит в пользу того, что электрическая проводимость определяется движением шаровыт ионов в вязкой среде. [27]
Значения энергии активации, вычисленные для первой [ уравнение ( 171) ] и последующих реакций [ уравнения ( 172) и ( 174) ] составляют соответственно 14 4 и 16 0 ккал / моль. [28]
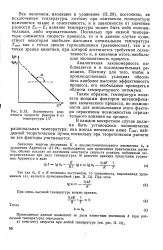 |
Зависимость константы скорости реакции k от температуры 1 / Т. [29] |
Значения энергии активации Е и предэкспоненциального множителя ka в уравнении Аррениуса (11.24), необходимого для проведения практических расчетов, обычно находят по значениям константы скорости реакции, найденным экспериментально при двух температурах. [30]
Страницы: 1 2 3 4 5