Значение - внутренняя энергия
Cтраница 1
Значение внутренней энергии в каком-либо произвольно выбранном состоянии системы не зависит от того, каким образом система пришла в это состояние. [1]
Значения внутренней энергии в таблицах не приводятся, их нельзя получить непосредственно и из i s - диа-граммы. [2]
Значение внутренней энергии в каком-либо произвольно выбранном состоянии системы не зависит от того, каким образом система пришла в это состояние. Иначе говоря, изменение внутренней энергии At / i 2 при переходе системы из состояния / в состояние 2 не зависит от вида процесса перехода и равно А. [3]
Значения внутренней энергии могут быть подсчитаны по простому соотношению u i - Apv. Таблицы Вукаловича обладают высокой степенью точности. [4]
Значения внутренней энергии и других термодинамических функций, перечисленных выше, неопределенны. Измерить можно лишь разность между внутренней энергией системы в данном состоянии и некотором состоянии, принятом за начальное. То же справедливо и для химического потенциала компонента, представляющего собой производную от внутренней энергии по числу молей данного компонента. Поэтому для количественной характеристики химического потенциала необходимо установить начальное состояние компонента, от которого следует вести отсчет изменения химического потенциала. [5]
Значение внутренней энергии U полностью определяется параметрами состояния термодинамической системы. Напомним, что три параметра - давление Р, объем V, температура Т - полностью характеризуют состояние однородных и изотропных тел, в частности, идеального газа. Действительно, внутренняя энергия определяется через работу над системой внешних сил в адиабатическом процессе, которая, в свою очередь, зависит только от параметров системы в нулевом ( Ро о То) и рассматриваемом ( Р, V, Т) состояниях. [6]
Значение внутренней энергии сухого насыщенного пара можно получить по общей формуле ( 2 - 27) и i - pv; здесь все величины, стоящие в правой части, могут быть взяты из таблиц. [7]
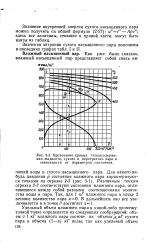 |
Протекание кривых теплосодержания жидкости, сухого и перегретого пара в зависимости от параметров состояния. [8] |
Значение внутренней энергии сухого насыщенного пара можно получить по общей формуле ( 2 - 27): u i - Apv здесь все величины, стоящие в правой части, могут быть взяты из таблиц. [9]
Однако разность значений внутренней энергии должна быть такой же, как и в случае адиабатического изменения, так как эта разность зависит только от начального и конечного состояний. [10]
Обозначим через U0 значение внутренней энергии в отсутствие намагниченности. [11]
Формула (6.39) определяет значение внутренней энергии одного моля одноатомного идеального газа. [12]
Находим из табл. 9 значение внутренней энергии продуктов сгорания для а 0 9 при tz 2300 С U 2зоо с 67213 кДж / кмоль. [13]
Полученное выражение представляет собой прибавку к значению внутренней энергии [ см. формулу (4.23) ], вызванную колебательными движениями атомов в молекуле. Однако формула (5.5) годна лишь для двухатомного газа, так как дает значение энергии, приходящееся только на одну степень свободы гармонического колебательного движения. [14]
По уравнению Ван-дер - Ваальса вычисляется также значение внутренней энергии. После этого дается формула теплоемкости насыщенного пара, рассматривается с применением уравнения Ван-дер - Ваальса процесс Джоуля - Томсона и выводится уравнение адиабаты для вандерваальсовского газа. Эти же вопросы были в 1918 г. рассмотрены в учебнике Брандта. [15]
Страницы: 1 2 3 4