Значение - наблюдаемая энергия - активация
Cтраница 2
При введении добавки окиси калия реакционная способность образцов карбида железа снижается, значение наблюдаемой энергии активации несколько возрастает, заметно изменяется наблюдаемый порядок реакции. [16]
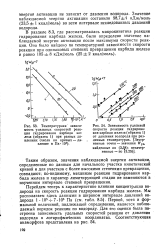
В разделе 8.3, где рассматривалась макрокинетика реакции гидрирования карбида железа, было определено значение наблюдаемой энергии активации после максимума скорости реакции. [18]
На основе изложенного для выяснения области протекания реакции на участке после максимума скорости были определены значения наблюдаемой энергии активации по температурной зависимости скоростей реакции при заданной степени превращения. [20]
Как видно, эти зависимости подобны аналогичным зависимостям для гомогенных реакций, а получаемые из них значения наблюдаемой энергии активации и порядка реакции практически не зависят от давления водорода и температуры соответственно, демонстрируя таким образом отсутствие видимых аномалий. [22]
 |
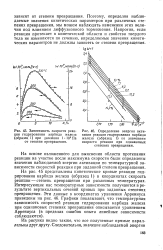
Влияние добавок на реакционную способность железа в реакции карбидирования. [23] |
Добавка окиси калия приводит к снижению реакционной способности железа и к резкому возрастанию в реакции карбидирования значений наблюдаемой энергии активации. [24]
Наиболее интересны результаты, полученные для образцов 12 - 14, содержащих добавки окислов алюминия и калия. Влияние добавок на значение наблюдаемой энергии активации реакции карбидирования железа почти аддитивно. [25]
Хотя механизм влияния катиона на каталитические свойства цеолитов далеко неясен, полученные данные бесспорно-говорят о большом значении вклада катиона в активность цеолита. Тот факт, что значения наблюдаемых энергий активации на декатио-нированных и катионных формах практически одинаковы, свидетельствует о близкой природе активных центров на этих цеолитах в реакции крекинга кумола. [26]
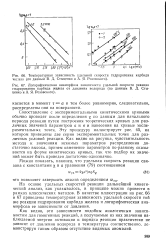
Интервал значений h ( 0 2 h 2) соответствует реакции, протекающей в переходной области. Для переходной области характерны промежуточные закономерности, в том числе значения наблюдаемой энергии активации промежуточные между ее истинным значением и его половиной. [27]
Интервал значений h ( 0 2 С h 2) соответствует реакции, протекающей в переходной области. Для последней, как и в слу-чге внешней задачи, характерны промежуточные закономерности, 1Й частности, значения наблюдаемой энергии активации в этой области лежат в интервале между истинным значением и его половиной. [28]
Интервал значений h ( 0 2 h 2) соответствует реакции, протекающей в переходной области. Для последней, как и в случае внешней задачи, характерны промежуточные закономерности, в частности, значения наблюдаемой энергии активации в этой области лежат в интервале между истинным значением и его половиной. [29]
Наблюдаемый порядок реакции по газообразному реагенту - окиси углерода - близок к нулю ( табл. 7.4); значения наблюдаемой энергии активации составляют 125 - - 138 кДж / моль ( 30 - - 33 ккал / моль) для образца, не содержащего введенных добавок, и 105 кДж / моль ( 25 ккал / моль) для образца, содержащего добавки окислов калия и ванадия. [30]
Страницы: 1 2 3