Значение - энтропия - активация
Cтраница 1
Значения энтропии активации для различных реакций могут отличаться на много порядков. [1]
Кроме того, значение энтропии активации этой реакции, равное - 22 5 кал / моль / град ( - 94 5 Дж / моль / град), очень большое ( по абсолютной величине), что не характерно для истинно мономолекулярной реакции. Для этой цели было исследовано влияние заместителей на скорость гидролиза 4 - и 5-замещенных аспиринов. [2]
В табл. 45 приведены значения энтропии активации, вычисленные по этим уравнениям, причем температура полагалась равной 300 Кг момент инерции - 10 - 49 г-см, а т - единице атомного веса. [3]
Интересно установить, при каком значении энтропии активации простая теория столкновений даст правильные результаты, или, иными словами, какая энтропия активации отвечает нормальной бимолекулярной реакции ( гл. [4]
Петровский [24] рассчитал по данным [11] значения энтропии активации Текучести в области температур размягчения ( 175 энтр. Согласно обнаруженной Немиловым [25] корреляции между величинами энтропии активации и валентной структурой стекол, это свидетельствует, что в структуре нитратного стекла преобладают молекулярно-цепочечные комплексы. [5]
При этом предполагается, что в значениях энтропии активации нет существенных различий - вполне вероятное допущение для стерически незатрудненных мономеров. Этот порядок активности представляет в общем виде данные табл. 6.3 и 6.4 и многие данные по гомополимеризации. [6]
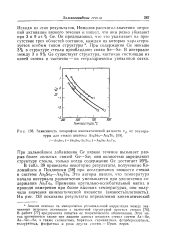 |
Зависимость логарифма кинематической вязкости vst от температуры для стекол системы As2Se3 - As2Te3 [ 58j. [7] |
Исходя из этих результатов, Немилов рассчитал значения энтропии активации вязкого течения и нашел, что они резко убывают при 3 и 9 ат. При содержании Ge меньше 3 % в структуре стекла преобладают связи Se-Se. В интервале между 3 и 9 % Ge существует структура, частично состоящая из цепей селена и частично - из тетраэдрически увязанной сетки. [8]
Интересно, далее, установить, при каком значении энтропии активации простая теория столкновений даст правильные результаты, или, иными словами, какая энтропия активации отвечает нормальной бимолекулярной реакции ( гл. [9]
Оценка сделана на основании предположения, что для этих кислот значения энтропии активации заметно не различаются. [10]
Скорость реакции зависит от структуры поверхности и конфигурации активированного комплекса, определяющих величину и значение энтропии активации. [11]
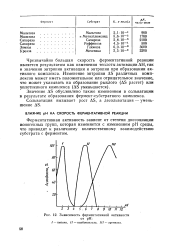 |
Зависимость ферментативной активности. [12] |
Чрезвычайно большая скорость ферментативной реакции является результатом как изменения теплоты активации АН, так и значения энтропии активации и энтропии при образовании активного комплекса. [13]
В соответствии с этим для изомеризации о - или - ксилола наблюдалась неожиданно реакция второго порядка, хотя значение энтропии активации составляет около 0 кал / град моль и, следовательно, указывает на мономолекулярную реакцию. Ка) и константе скорости &, перегруппировки а-комплекса: kc v - Ka-fiu ( k ( l определяет скорость реакции, см. также стр. [14]
Это осуществляется двумя путями: а) снижением теплоты активации [361] и б) благодаря ступенчатому механизму, при котором устраняются неблагоприятные значения энтропии активации на стадии, определяющей скорость реакции. В основе последней предпосылки лежит следующее: так как энтропия сольватации для заряженных ионов является более отрицательной, чем для нейтральных молекул, то в том случае, когда происходит нейтрализация заряда при образовании активированного комплекса, энтропия активации возрастает, что приводит к ускорению реакции. По-видимому, именно такую функцию и выполняют ионы металла. [15]
Страницы: 1 2