Результат - электрохимическое исследование
Cтраница 1
Результаты электрохимических исследований хорошо коррелируют с данными, полученными при исследовании физико-химических и защитных характеристик покрытий, а также с результатами натурных испытаний. [1]
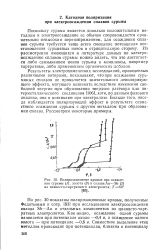 |
Поляризационные кривые при осаждении сурьмы ( /, золота ( 3 и сплава Аи-Sb ( 2 из цианисто-тартратного электролита. Т 60. [2] |
Результаты электрохимических исследований, проведенных различными авторами, показывают, что при осаждении сурьмяных сплавов не проявляется значительного деполяризующего эффекта, могущего возникать вследствие изменения свободной энергии при образовании твердого раствора или интерметаллического соединения [106], хотя, по данным фазового анализа, они и возникают при электролизе. Больше того, иногда наблюдается поляризующий аффект IB результате совместного осаждения сурьмы с другим металлом при образовании сплава. [3]
 |
Изменение во времени электродных потенциалов в 0 01 % - ном водном растворе бензосульфокислоты. [4] |
Результаты электрохимических исследований и корозионных испытаний свидетельствуют о том, что коррозия металлов в обводненных нефтепродуктах определяется в основном склонностью углеводородных и неуглеводородных компонентов к образованию агрессивных водорастворимых продуктов окисления. [5]
 |
Кривые анодной поляризации стали марки 20ХНЗА. [6] |
Результаты электрохимических исследований по анодной поляризации стали представлены в табл. 13 и на рис. 30, где в качестве примера показаны анодные поляризационные кривые, снятые в глинистом растворе с добавкой 2 % смеси гудронов. [7]
Результаты электрохимических исследований хронистах сталей 03125 и 15X28 в сравнении со сталью 08XI8HIOT согласуются с литературщин данными [3-5] по коррозионной стойкости высокохро-миствх ферритннх сталей. Как промшленные, так и лабораторные исследования показывают значительно более высокую стойкость без-никелевнх сталей в сравнении с высоконикелевыми сталями в горячих концентрированных щелочных растворах, что позволяет сделать заключение о перспективности использования безникелевых высоко-хромистых нержавеющих сталей в аппаратурном оформлении химических производств, содержащих в качестве технологической среды горячие концентрированные щелочные растворы. [8]
Результаты электрохимических исследований в щелочном растворе ( 50 % NaOH без хлорида или с 0 2 % С1 при 135 - 140 С) показали, что поведение сталей 26 - IS и 26 - 1 одинаково: обе они в этих условиях находятся в пассивном состоянии. Сталь 26 - 1, имеющая прекрасную коррозионную стойкость в щелочных средах, используют в качестве конструкционного материала для оборудования в производстве щелочи. [9]
Результаты детально проведенных электрохимических исследований электродов ( потенциодинамия, I-т-кривые, токи заряжения) в растворах сульфатов показали каталитическую активность карбидов в реакции выделения водорода. Механизм катализа на них и на рассмотренных выше соединениях вольфрама ( WC, W2C) сходен, за исключением явления анодной активации, характерной для последних. [10]
Рассмотрим результаты электрохимических исследований пористых серебряных электродов. В случае кислородного электрода лри постоянном перепаде давления наблюдается заметная зависимость электрохимической активности от парциального давления кислорода. [11]
В результате электрохимических исследований установлено, что причина повышения скорости коррозии - активирование поверхности металла в присутствии грибов, в том числе легко пассивируемых в обычных условиях металлов. Например, сплавы свинец-олово ( 10 % олова) и алюминиевые ( В-95) в присутствии Aspergitlus niger и Trichoderma lignorum подвергались значительной коррозии, причем образцы из сплава свинец-олово полностью разрушались за 15 сут. [12]
В результате электрохимических исследований установлено, что увеличение скорости коррозии в кислых средах связано с облегчением катодной реакции восстановления водорода. В щелочной среде повышение скорости коррозии алюминиевых сплавов сопровождается резким разблагораживанием потенциалов, вызванным растворением окисной пленки на поверхности сплава и переходом его в активное состояние. В сильнощелочных средах потенциал активированной поверхности смещается в отрицательную сторону до тех пор, пока не достигается потенциал выделения водорода из молекул воды. [14]
 |
Влияние рН раствора, содер - [ IMAGE ] II Влияние концентрации. [15] |
Страницы: 1 2 3
