Результат - электрохимическое исследование
Cтраница 2
В результате электрохимических исследований установлено, что увеличение скорости коррозии в кислых средах связано с облегчением катодной реакции восстановления водорода. В щелочной среде повышение скорости коррозии алюминиевых сплавов сопровождается резким разблагораживанием потенциалов, вызванным растворением окисной пленки на поверхности сплава и переходом его в активное состояние. В сильнощелочных средах потенциал активированной поверхности смещается в отрицательную сторону до тех пор, пока не достигается потенциал выделения водорода из молекул воды. [16]
В результате электрохимических исследований установлено т что при плотности тока 0 1 ма / см2 в растворе 300 г / л NaCl при температуре 90 С потенциал питтингообразования титана, равный: 6 - 6 2 в, достигается в течение 30 - 40 часов, а при 1 ма / см2 - в-первые минуты поляризации. После испытаний на образцах отмечаются сквозные разрушения местного характера. [17]
Рассмотрим теперь результаты электрохимических исследований пористых серебряных электродов. В случае кислородного электрода наблюдается заметная зависимость электрохимической активности при постоянном перепаде от парциального давления кислорода. [19]
На основании результатов электрохимических исследований Элан-дера [91, 92, 94] вычислены изменения парциальных термодинамических величин для менее благородных металлов в следующих промежуточных фазах переменного состава: 1) р, у и в в системе Аи-Cd; 2) Р, Р, у, б и е в системе Ag-Cd; 3) р, р, у и е в системе Си-Zn; 4) 7 и е в системе Bi - Т1 и 5) Р в системе РЬ-Т1. Если результаты этих расчетов изобразить в виде графиков, то оказывается, что по их виду можно легко различать бертоллиды и дальтониды в промежуточных фазах. [20]
В сборнике помещены результаты электрохимических исследований окислов железр. [21]
Эту особенность подтверждают результаты электрохимических исследований - зависимость стационарного потенциала от концентрации гипофосфита, ионов никеля, показателя рН ( см. рис. 19 - 21, 24), образование максимума на анодных кривых ( см. рис. 28), соответствующего окислению водорода. [22]
В сборнике приведены результаты электрохимических исследований пассивности металлов и сплавов. Основные особенности пассивного состояния металлов объяснены на основании сопоставления электрохимического поведения металлов и их окис лов. [23]
В четвертой главе приведены результаты электрохимических исследований воды, прошедшей электрокоагуляционную доочистку. [24]
В работе [8] приводятся результаты электрохимического исследования расплава KCI - SnCb, выполненного при помощи низкочастотной поляроскопической установки. При достаточно быстром наложении напряжения на поляризационной кривой появляется участок предельного тока. [25]
Учитывая, что надежность результатов электрохимических исследований часто определяется степенью чистоты растворителя, автор отводит определенное место обсуждению методов анализа и очистки апротонных растворителей. Для однозначного изучения систем электродов сравнения требуются чистые растворители. [26]
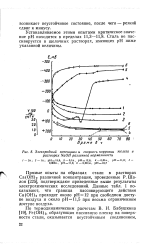 |
Электродный потенциал и скорость коррозии железа в растворах NaOH различной нормальности. [27] |
Ша-лон [225], подтверждают приведенные выше результаты электрохимических исследований. Данные табл. 1 показывают, что граница пассивирующего действия Са ( ОН) 2 проходит около рН 12 при свободном доступе воздуха и около рН 11 5 при весьма ограниченном доступе воздуха. [28]
Прямое и косвенное участие бактерий в МИК углеродистых сталей подтверждают также результаты электрохимических исследований в присутствии СРВ. [29]
Установлено, что легирование медью повышает коррозионную стойкость стали. Результаты электрохимических исследований показывают, что это может быть объяснено смещением потенциала коррозии из области активного растворения в пассивную. [30]
Страницы: 1 2 3
