Результат - кинетический опыт
Cтраница 1
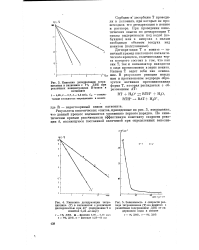
Результаты кинетических опытов, приведенные на рис. 6, показывают, что данный процесс подчиняется уравнению первого порядка. [2]
Результаты кинетических опытов по гидролизу этилацетата свидетельствуют в пользу реакции первого порядка. [3]
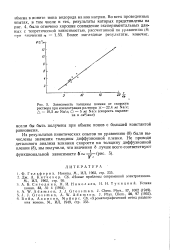 |
Зависимость толщины пленки от скорости раствора при концентрации раствора X - 22 4 мг Na / л. А - 10 5 мг Na / л. О - 5 мг Na. / л ( скорость выражена в см3 / мин. [4] |
Из результатов кинетических опытов по уравнению ( 8) были вычислены значения толщины диффузионной пленки. [5]
Надежность результатов кинетических опытов зависит от степени стабильности условий этих опытов и от точности измерений. [6]
Для количественной обработки результатов кинетических опытов по сорбции и ионному обмену, в том числе на породах и почвах, необходимо определить, в какой кинетической области лежит процесс. [7]
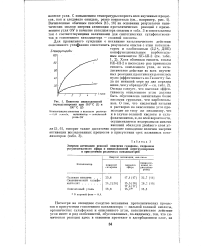 |
Кинетика пинаколиновой перегруппировки при 110 С ( Т и 130 С ( 2. [8] |
Вычисленные обычным способом [15, 16] на основании результатов кинетических опытов энергии активации протолитических реакций с применением угля ОУ в качестве катализатора сведены в табл. 3 и сопоставлены там с соответствующими величинами для синтетических сульфокатиони-тов и гомогенного катализатора - соляной кислоты. [9]
Ниже приведена схема, предложенная на основании результатов кинетических опытов и литературных данных 5, описывающая реакцию окисления толуола в виде последовательных стадий образования различных промежуточных продуктов. [10]
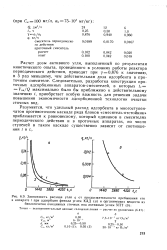 |
Зависимость расхода угля q от продолжительности пребывания его в аппарате t при адсорбции фенола углем КАД ( а и органических веществ из. [11] |
Расчет дозы активного угля, выполненный по результатам кинетического опыта, проведенного в условиях работы реактора периодического действия, приводит при у 0 876 к значению, в 5 раз меньшему, чем действительная доза адсорбента в проточном смесителе. [12]
Путем интегрирования и применения условия стационарности удается получить довольно сложные выражения [55], которые описывают результаты отдельного кинетического опыта в виде кинетической кривой для реакции первого порядка, причем константа первого порядка представляет собой произведение бимолекулярной константы на исходную концентрацию. [13]
В литературе, посвященной кинетике гетерогенного катализа углеводородов, до настоящего времени отсутствует единая общепринятая методика обработки результатов кинетических опытов. [14]
На рис. ХП-9 и ХП-10 графически представлены характеристики реакционной способности частицы постоянного размера в тех случаях, когда стадиями, определяющими скорость процесса, являются химическая реакция, диффузия через газовую пленку и диффузия через слой золы. Результаты кинетических опытов для различных периодов процесса, сопоставленные с приведенными теоретическими кривыми, позволяют быстро найти, какая стадия является лимитирующей для данного процесса. К сожалению, разница между тормозящим влиянием химической реакции и диффузии через слой золы мала. Поэтому при наличии разброса экспериментальных данных указанные эффекты относительно трудно разделить. [15]
Страницы: 1 2