Тримолекулярная рекомбинация
Cтраница 1
Тримолекулярная рекомбинация как возможный путь обрыва цепей обычно характеризуется константой скорости порядка 1016 см6 / ( моль2 - с) при комнатной температуре. С увеличением температуры константа скорости тримолекулярного процесса немного уменьшается. При типичном значении полной концентра ции приблизительно 10 - 5 моль / см3 ( давление 0 25 атм, комнатная температура) это соответствует эффективной константе скорости реакции второго порядка 10 см3 / ( моль-с), что примерно в 104 раз меньше значения & Соуд, обсуждавшегося ранее. Таким образом, тримолекулярная рекомбинация активных центров не может быть достаточно быстрой, чтобы уменьшить время жизни носителей цепи до 10 - 5 с, пока концентрация активных частиц не достигнет значения 10 - 6 моль / см3; последнее сравнимо с предложенными нами значениями концентраций исходных реагентов. [1]
Действительно, прямая реакция есть обычная тримолекулярная рекомбинация атома с радикалом, и она не должна иметь высокий активационный барьер Е j ( 0 - т - 2) ккал / моль при сильно пониженном пред-экспоненте. [2]
Вычисление Л - факторов для тримолекулярной рекомбинации некоторых простейших алкильных радикалов изо-строения показало ( табл. 13.4), что они мало различаются между собой и равны 2 - 10 - 43 л2 - молекула - - а-с - г. В среднем это значение несколько ниже, чем в остальных реакциях. [3]
При давлении 1 атм скорость тримолекулярной рекомбинации примерно в 25 раз меньше, чем скорость бимолекулярной рекомбинации. Относительная скорость тримолекулярной рекомбинации убывает пропорционально давлению. [4]
Реакция ( XX) играет существенную роль при режимах интенсивного обрыва цепей путем гетерогенной или тримолекулярной рекомбинации других активных центров. [5]
Таким образом, несоответствие с опытными данными является следствием пренебрежения энергией активации и стерическими факторами реакции тримолекулярной рекомбинации атомов. [6]
Оно состоит в том, что вычисленная по отношению констант скорости прямой и обратной реакций константа равновесия реакции тримолекулярной рекомбинации атомов согласуется с опытным значением лишь при условии равенства стерического фактора реакции диссоциации молекул брома 100, что физически невероятно. При этом предполагается, что энергия активации тримолекулярной рекомбинации атомов брома равна нулю. [7]
Кинетической причиной этого является большая величина констант скорости таких процессов, малая вероятность высветить энергию при рекомбинации и сравнительно небольшая частота тримолекулярных рекомбинаций. Энергетическая же возможность диссоциативной рекомбинации обусловлена тем, что потенциалы ионизации молекул больше энергий разрыва связи между атомами. Таким образом, процесс диссоциативной рекомбинации ионов оказывается одним из важнейших с точки зрения химика. В нем пара ионов рождает два ( может быть, даже три) свободных радикала или новых молекулы. [8]
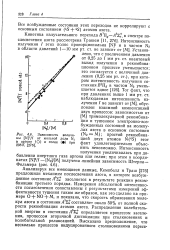 |
Зависимость величины [ N ] 2 / / ОТ МОЛЬНОЙ ДОЛИ NJ. [9] |
Тот факт, что при давлениях выше 1 мм рт. ст. наблюдаемая интенсивность излучения / не зависит от [ М ], обусловлен взаимной компенсацией двух процессов: зависимостью от [ М ] тримолекулярной рекомбинации и тушением электронно-возбужденных состояний на молекулах азота в основном состоянии ( N2 М); простой рекомбинацией двух атомов N ( 45) этот факт удовлетворительно объяснить невозможно. [10]
При давлении 1 атм скорость тримолекулярной рекомбинации примерно в 25 раз меньше, чем скорость бимолекулярной рекомбинации. Относительная скорость тримолекулярной рекомбинации убывает пропорционально давлению. [11]
Поскольку Л ( 3) для всех реакций принимает практически одина-ковыезначения ( табл. 13.2), стерические факторы варьируют в очень узких пределах 1 ( Н-10-7 и являются поэтому характеристической величиной для данного класса реакций. Эти значения ниже, чем в случае тримолекулярной рекомбинации атомов, так как пространственные затруднения выражены сильнее. Если принять энтропийную формулировку предэкспоненциальных и стерических факторов, то их постоянство означает, что энтропия активации практически одинакова во всех этих реакциях. [12]
Оно состоит в том, что вычисленная по отношению констант скорости прямой и обратной реакций константа равновесия реакции тримолекулярной рекомбинации атомов согласуется с опытным значением лишь при условии равенства стерического фактора реакции диссоциации молекул брома 100, что физически невероятно. При этом предполагается, что энергия активации тримолекулярной рекомбинации атомов брома равна нулю. [13]
Несомненно, что достижение парциального равновесия с сохранением числа частиц - только удобное приближение, главная ценность которого в том, что равновесие поддерживается при конечной скорости рекомбинации. Основным фактором, определяющим достижение равновесия, служат относительно малая скорость тримолекулярной рекомбинации при низких давлениях газа и достаточно высокие температуры. [14]
Из приведенных данных следует, что образование стабильной молекулы из атомов с излучением избыточной энергии является сравнительно мало вероятным процессом. Поэтому при обычных температурах и давлениях образование молекул, сопровождаемое излучением света, не может иметь существенного значения по сравнению с тримолекулярной рекомбинацией. Однако, судя по распространенности сплошного излучения пламен, радиационная рекобмипа-ция, по-видимому, играет существенную роль в излучении пламени. [15]
Страницы: 1 2