Ретинальдегид
Cтраница 1
Ретинальдегид ковалентно связывается с белком путем образования шиффова основания ( или альдимина) между его альдегидной группой и аминогруппой опсина. Однако имеются некоторые экспериментальные данные, свидетельствующие в пользу альтернативной гипотезы, согласно которой шиффово основание, по крайней мере на некоторых стадиях процесса зрения, может образовываться при участии аминогруппы этаноламинового остатка фос-фатидилэтаноламина. [1]
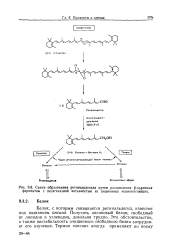 |
Схема образования ретинальдегида путем расщепления р-каротииаг ферментом с оксигеиазной активностью из кишечника млекопитающих. [2] |
Белок, с которым связывается ретинальдегид, известен под названием опсина. Получить опсиновый белок, свободный от липидов и углеводов, довольно трудно. Это обстоятельство, а также нестабильность очищенного свободного белка затрудняет его изучение. [3]
Почти все исследования по связыванию ретинальдегида л опсина были проведены с родопсином, выделенным из палочек сетчатки позвоночных, главным образом на примере крупного рогатого скота. По-видимому, другие зрительные пигменты в основном сходны с этим родопсином. Необходимо рассмотреть два вида связывания - первичное связывание, с помощью которого ретинальдегид ковалентно присоединяется к функциональной группе опсина, и вторичное, обусловленное нековалент-ными взаимодействиями. [4]
Чрезвычайно важны также нековалентные взаимодействия между ретинальдегидом и опсином, особенно взаимодействия между боковыми группами аминокислот и я-электронной системой полиена. Подобные взаимодействия определяют конфор-мацию хромофора, а также вызывают поляризацию я-электрон-ной системы. Именно эти эффекты и обусловливают незначительные вариации величины Ятах у разных зрительных пигментов. [5]
Этот подход оказался чрезвычайно полезным при изучении связывания ретинальдегида с опсином в зрительных пигментах ( гл. [6]
Картина до некоторой степени усложняется вследствие существования нескольких цис - и транс-изомеров ретинальдегида, которые легко превращаются друг в друга в результате фотохимических реакций. [7]
Было показано, что у млекопитающих, лягушек и змей ретинен представляет собой ретинальдегид ( XXVIII) - продукт окисления витамина А. [8]
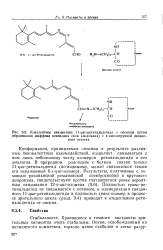 |
Ковалентное связывание 11-чис-ретинальдегида с опсином путем образования шиффова основания ( или альдимина с 8-аминогруппой лизино. [9] |
Конформация, принимаемая опсином в результате различных нековалентных взаимодействий, позволяет связываться с ним лишь небольшому числу изомеров ретинальдегида и его аналогов. Полностью трамс-ре-тинальдегид не связывается с опсином, и изомеризация связан-ного 11 - с-ретинальдегида в полностью трамс-изомер в процессе зрительного цикла ( разд. [10]
Однако пока не удалось установить соответствия между различными промежуточными продуктами, выявленными по характерным для них спектральным свойствам, и теми или иными конфигурациями и конформациями комплекса ретинальдегид - оп-син. [11]
Процесс фотообесцвечивания приводит к расщеплению родопсина на составляющие компоненты - опсин и ретинальде-гид. Ретинальдегид, высвободившийся в виде полностью трансизомера, прежде чем вновь связаться с опсином, должен превратиться в 1 l - wc - форму. [12]
Ретинадьдегид, связанный с опсином, образует красный зрительный пигмент палочек, называемый родопсином. Ретинальдегид, связанный с другим неидентифицированным белком, который Уолд назвал фотопсином, образует пигмент колбочек-йодопсин. Йод-опсин впервые был получен в результате обработки in vitro фотопсина колбочек глаза цыпленка. Его максимум поглощения лежит около 5700 А, и он, вероятно, служит наиболее важным пигментом колбочек у большинства млекопитающих, у которых максимальная чувствительность фотопического ( дневного) зрения находится в той же области. [13]
 |
Возможные пути превращения полностью грокс-ретинальдегида в 11-цыс-ретинальдегид в процессе регенерации родопсина. [14] |
Путь регенерации родопсина через фонды ретинола и рети-ниловых эфиров в пигментном эпителии обеспечивает эффективное обновление ретинальдегидной части всех зрительных пигментов палочек и колбочек. Потери ретинальдегида возмещаются из запасов в пигментном эпителии. [15]
Страницы: 1 2