Истинное значение - константа
Cтраница 2
Большинство методов позволяет рассчитать лишь кажущуюся константу диссоциации реагента, так как она зависит от ионной силы раствора и только при бесконечном разбавлении становится равной истинной величине. Для определения истинного значения константы диссоциации либо дополнительно определяют коэффициенты активности составляющих протолитического равновесия, либо, получив ряд кажущихся значений констант диссоциации при различной ионной силе раствора, применяют графическую экстраполяцию на нулевую ионную силу. [16]
Константа Трутона для JF, равна 26 4 [7]; однако расчет этой величины основан на данных теплоты сублимации, а не теплоты испарения. Это дает основание считать, что истинное значение константы Трутона должно быть ниже. Таким образом, гептафторид иода ни в газообразном, ни в жидком состоянии не проявляет свойств ассоциированного соединения. [17]
Значительно более детальная картина простого процесса полимеризации, получается при рассмотрении истинных значений констант скорости реакций развития цепи и обрыва ее. К сожалению, эти величины нельзя получить из измерений суммарной кинетики, так, хотя 7 в уравнении ( 9) можно часто-определить независимо, но kp и kt не удается разделить. Вместо этого необходимо провести исследования при специальных условиях, при которых не существовало бы концентрации радикалов устойчивого состояния, например фотоиндуцируемая полимеризация под воздействием неустойчивого источника света. Этот метод, впервые предложенный Чэпменом, Брайерсом и Уолтерсом [31], но лишь недавно примененный, к реакциям полимеризации [15, 27], оказался наиболее плодотворным. Его часто описывают как метод вращающегося сектора после обычных средств изменения интенсивности инициирующего реакцию света. Хотя принцип его прост и понятен из приведенных ниже объяснений, но практическое применение его может оказаться довольно сложным. [18]
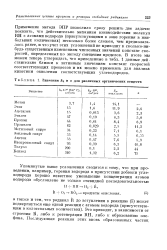 |
Значения k & и а для различных органических веществ. [19] |
Применение метода ЭПР позволило сразу решить две задачи: показать, что действительно механизм взаимодействия молекул RH с атомами водорода ( присутствующими в зоне горения в наибольших количествах) несколько более сложен, чем предполагалось ранее, и что учет этих усложнений не приводит к сколько-нибудь существенным изменениям численных значений констант скоростей, определенных по методу смещения пределов. В итоге мы можем теперь утверждать, что приведенные в табл. 1 данные действительно близки к истинным значениям констант скоростей соответствующих процессов и их можно применять для анализа кинетики окисления соответствующих углеводородов. [20]
Для приведенных на рисунке случаев согласие с уравнением Гамметта вполне удовлетворительное. Легко видеть, что значения р различны в зависимости от типа реакции: и соответствии с этим их называют константами реакций. Однако истинное значение константы р заключается в том, что она служит мерой чувствительности реакций к электронным эффектам заместителей, находящихся в мета-н / гора-положениях. Высокое значение р, положительное или отрицательное, означает большую чувствительность реакции к влиянию заместителей. [21]
И дополнение к изложенному выше заметим, что не только отношения констант внутри групп, но и их соотношения в разных группах кажутся вполне разумными. Так, например, среди констант скоростей нерадиационньтх процессов максимальное значение имеют константы рекомбинационных процессов. К сожалению, истинные значения констант группы А определить было нельзя, поскольку в экспериментах [192] мощность дозы неизвестна. [22]
Установление кинетических соотношений, описывающих ход реакций, и расчет входящих в них констант являются конечной целью всякого прикладного химического исследования. Особенно это важно для разработки промышленных процессов. Здесь необходимо подчеркнуть, что определение истинных значений констант скоростей элементарных стадий окисления представляет собой весьма трудную задачу, которую до настоящего времени можно решить только экспериментальным путем. [23]
Обе четырехокиси летучи с водяным паром. В водных растворах они ведут себя как очень слабые амфотерные электролиты с преобладанием кислотных свойств. Следует отметить, что равновесия ЭО4 пНоО Э04 яН30 очень сильно смещены влево и поэтому истинные значения констант диссоциации гидратированных форм тетроксндов должны быть выше ( ср. Водный раствор RuO4 ( растворимость 20 г / л) довольно быстро разлагается. Интересна значительно более высокая растворимость RuO4 и OsO4 в органических жидкостях по сравнению с водой. Например, 100 г СС14 при 25 С растворяют 375 г OsO4, тогда как 100 г воды при тех же условиях - только 7 г. Коэффициент распределения ( VII § 4 доп. [24]
Обе четырехокиси летучи с водяным паром. В водных растворах они ведут себя как очень слабые амфотерные электролиты с преобладанием кислотных свойств. Следует отметить, что равновесия ЭО4 nHjO з 5 ЭО4 - пНаО очень сильно смещены влево и поэтому истинные значения констант диссоциации гидратированных форм тетроксидов должны быть выше ( ср. Водный раствор Ru04 ( растворимость 20 - г / л) довольно быстро разлагается. Интересна значительно более высокая растворимость RuO4 и OsO4 в органических жидкостях по сравнению с водой. Например, 100 г СС14 при 25 С растворяют 375 г OsO4, тогда как 100 г воды при тех же условиях - только 7 г. Коэффициент распределения ( VII § 4 доп. [25]
С развитием электронной вычислительной техники появилась возможность использовать для нахождения оценок констант математических моделей различные методы последовательных приближений ( итерационные) [10-12], которые вследствие слишком большого объема вычислительной работы ранее не находили большого практического применения ( см также гл. Однако все эти итерационные методы требуют задания некоторых предварительных оценок искомых констант. Поэтому успешное их применение ( меньшее время счета и более надежные результаты счета) зависит от того, насколько ближе к истинным значениям констант подходят значения их предварительных оценок. [26]
Кинетические исследования показывают, что в подобных реакциях весьма значителен вклад энтропийного фактора в увеличение скорости процесса. Здесь, однако, нужно сказать, что при вычислении энтропийного фактора ( или энтропии активации) ферментативной реакции встречаются еще большие трудности, чем при расчете энергии активации. Если энергия активации может быть вычислена из зависимости скорости реакции от температуры по уравнению Аррениуса, то для расчета AS или Р необходимо знать истинные значения констант скоростей, что для ферментативных реакций не всегда доступно. [27]
Заметим, что наличие линейной зависимости в координатах Скэтчарда ( рис. 91, а) еще недостаточно для утверждения о протекании процесса по схеме (8.1), хотя и является существенным на это указанием. Дело в том, что прямолинейные зависимости в координатах Скэтчарда могут экспериментально наблюдаться и в более сложных случаях. Кинетические же эксперименты позволяют определить k, k - и / Ca &i / &-i в условиях, когда инактивацией центров связывания можно пренебречь ( начальные времена проведения процесса), и, следовательно, дают возможность найти истинные значения констант. [28]
При расчете нулевого механизма были, как отмечалось выше, взяты не известные значения констант, а испорченные величины. В результате поиска констант методом оврагов были получены расчетные их значения, которыми мы и пользуемся далее. В этом смысле нулевой механизм не имеет никаких преимуществ перед другими. Сопоставление расчетных и истинных значений констант приведено в конце этого параграфа. [29]
Следует отметить, что подобно тому, как с каждым годом уточняются значения констант автопротолиза неводных растворителей, уточняются и р / С кислот и оснований в неводных растворах. В работах разных авторов приводятся порой весьма противоречивые данные, иногда отличающиеся друг от друга на несколько-порядков. В особенности это относится к / Снлп -, которые в растворителях с низкой диэлектрической проницаемостью слишком малы для экспериментального определения. Разумеется, истинное значение константы диссоциации НАп - не имеет столь большого практического значения в химико-аналитическом аспекте, как константа автопротолиза растворителя. [30]
Страницы: 1 2 3