Близкое значение - константа - скорость
Cтраница 1
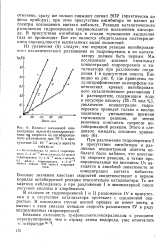 |
Влияшю начальной кон - гибированной реакции. Этого и следовало ожидать, согласно уравнению ( 6. [1] |
Близкие значения констант скоростей свидетельствуют о первом порядке ингибируемой реакции относительно катализатора. [2]
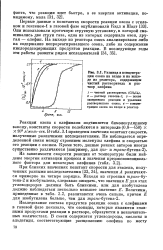 |
Разница в концентрации озона на входе и на выходе из реактора, содержащем чистый растворитель и раствор олефина. [3] |
При близких значениях констант скорости для этилена, полученных разными исследователями [33, 34], значения А различаются примерно на четыре порядка. [4]
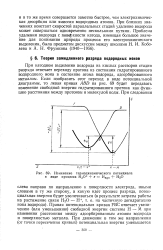 |
Изменение термодинамического потенциала в ходе процесса Н3О е Hagc ЩО. [5] |
При близких значениях констант скоростей параллельных стадий удаление водорода может совершаться одновременно несколькими путями. [6]
Отсюда следует ожидать близких значений константы скорости К для всех трех серий опытов. [7]
Реакции распада гидроперекисей имеют близкие значения констант скоростей, независимо от природы углеводорода. За исключением случая третич / 1л бутилгидроперекиси предэк-споненцпальные множители равны Ю12 - Ю13 сек. [8]
Параллельные реакции отрыва атома водорода и присоединения радикала по л-связи проходят с близкими значениями констант скорости. [9]
Таким образом, сравнение твердого и жидкого Ga приводит к выводу о замедленной стадии поверхностной диффузии на твердом электроде при небольшом перенапряжении и указывает на близкие значения констант скоростей переноса заряда в случае твердого и жидкого металлов. [10]
Комплексы типа [ MY ] n ( где М Coin ( NH3) 5 и Y одноосновная кислота) при восстановлении их хромом ( П) дают удивительно близкие значения констант скоростей. [11]
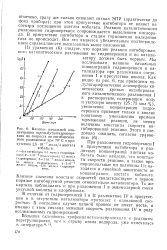 |
Влияние начальной концентрации т / е / й-бутилгидропере-киси на скорость ее ингиб. ирован-ного разложения при 70 С в присутствии 2 5 10 моль / л ацетата кобальта. [12] |
При разложении гидроперекиси I в присутствии ингибитора и различных концентраций ацетата кобальта было найдено, что константы скорости реакции, а также пропорциональные им величины 1 / т находятся в линейной зависимости от концентрации ацетата кобальта. Близкие значения констант скоростей свидетельствуют о первом порядке ингибируемой реакции относительно катализатора. [13]
 |
Изменение термодинамического потенциала в ходе процесса Н3О е Надо Н2О. [14] |
Замедленная рекомбинация, например, означает, что каталитическое образование молекул водорода отличается большим торможением, чем разряд или стадия транспортировки и в то же время совершается заметно быстрее, чем электрохимическая десорбция или эмиссия водородных атомов. При близких значениях констант скоростей параллельных стадий удаление водорода может совершаться одновременно несколькими путями. [15]
Страницы: 1 2