Близкое значение - энергия - активация
Cтраница 1
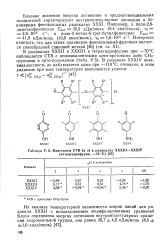 |
Константы СТВ ( в э в радикалах XXXIII-XXXIV ( тетрагидрофуран, - 70 С. [1] |
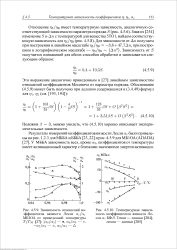
Близкие значения энергии активации и предэкпоненциальных множителей характеризуют внутримолекулярные движения в полимерных феноксильных радикалах XXXI. Интересно отметить, что для таких полимеров феноксильный фрагмент является своеобразной спиновой меткой [46] ( см. гл. [2]
Близкие значения энергии активации, найденные при гидратации изобутилена в присутствии катионообменной смолы ( 22 8 ккал / мол. [3]
Близкие значения энергии активации, найденные при гидратации изо-бутилена в присутствии катионообмешюй смолы ( 22 8 ккал / мол. [4]
 |
Фрактограмма ( 720х излома сварного соединения, полученного через УДП никеля. [5] |
Близкие значения энергий активации контактных поверхностей и пластической деформации никеля позволяют сделать вывод о том, что схватывание происходит на активных центрах в местах выхода дислокаций в зону физического контакта. [6]
Это подтверждается также близкими значениями энергии активации, которая составляет для этих саж 36 700 - 38 600 кал / моль. [7]
Следует отметить, что близкие значения энергий активаций процесса быстрого термического разложения получались также Андерсеном [149] ( при пиролизе) для одного и того же вещества разной степени полимеризации. [8]
Для стекол с соизмеримым содержанием германия и теллура получены близкие значения энергии активации электропроводности - 1 24 - 1 26 эв. [9]
В разделе 2.1 были приведены данные о близких перенапряжениях безбарьерного разряда ионов водорода в воде и этиленгликоле и были изложены соображения, по которым следовало ожидать близких значений энергии активации в этих двух случаях. [10]
Как следует из табл. 22, причиной повышенной селективности / fi-w катализатора к гидрированию ароматического кольца по сравнению с Wi - Mo является пониженная - вЗ раза энергия активации реакции гидрирования при близких значениях энергии активации реакции гидродесульфирования тиофена. [11]
Молекулы субстрата ориентированы своими реагирующими группами к поверхности катализатора. Это подтверждается очень близкими значениями энергии активации разных соединений в реакциях с одинаковыми индексами, например, для дегидрогенизации первичных спиртов на меди ( Констебл [20] и др.), дегидратации нормальных первичных спиртов на боксите и на окиси алюминия ( Дозе [41], А. Борк и А. А. Толстопятова [42, 43] и др.), а также нашими работами последнего времени ( см. гл. [12]
Опыт показывает, что во всех случаях мы получаем близкие значения энергии активации. Это не удивительно, так как согласно модели Френкеля и Эйринга энергия активации пропорциональна потенциальной энергии межмолекулярных связей. Исходя из этого, следует ожидать, что для ван-дер-ваальсовых систем энергия активации будет ниже, чем для систем с водородными связями. Такое предположение подтверждается экспериментально. [13]
При наличии объемных процессов образование пиро-углерода на поверхности ускоряется за счет захвата активных центров твердой поверхностью. Авторы считают, что механизм газофазного и поверхностного процессов одинаков, и это подтверждается близкими значениями энергии активации обоих процессов. В интервале температур 900 - 1100 С, по данным авторов, энергия активации поверхностного процесса составляет 74 ккал / моль, а объемного - 77 5 ккал / моль. [14]
Страницы: 1 2