Опытное значение - энергия - активация
Cтраница 1
Опытные значения энергий активации, характерные для реакций озона с непредельными соединениями, лежат в области, неблагоприятной для интерпретации. [1]
Опытное значение энергии активации для реакции образования окиси азота составляет 135 ккал / моль. [2]
Опытное значение энергии активации для электронного кремния при концентрации доноров менее 1016 см-3 составляет около 0.075 эл. С увеличением концентрации до 1019 см 3 величина U убывает до нуля. [3]
Опытное значение энергии активации для электронного кремния при концентрации доноров менее 1016 см-3 составляет около 0.075 эл. С увеличением концентрации до 10 9 см-3 величина U убывает до нуля. [4]
Теоретическое и опытное значения энергии активации одинаковы в пределах ошибок наблюдений. Предэкспоненты различаются в 2 5 раза. Реакция, несомненно, идет цепным путем. Длина цепи небольшая, порядка 10 звеньев. [5]
Розенберг пытался показать, что опытное значение энергии активации фотопроводимости в ряде кристаллов ароматических углеводородов представляет колебательную энергию, необходимую для перехода молекулы из первого возбужденного синглетного состояния в низшее триплетное. [6]
Мы видим, что при использовании реальных энергий активации теоретически вычисленные и опытные значения энергии активации могут непосредственно срчвниваться друг с другом и необходимость определения идеальных энергий активации отпадает. [7]
Для сопоставления этой формулы с результатами эксперимента необходима корректировка опытного значения энергии активации. Уравнения, которые не требуют такой корректировки, приведены в следующем разделе. Следует отметить, что обычно используемый в зарубежных источниках подход Лейдлера, Г лес-стона и Эйринга [39] дает значения предэкспоненциального множителя, совпадающего с таковым в уравнении ( 111 43), лишь в случае, если рассматривается одно поверхностное соединение либо если все адсорбированные частицы ( или все, кроме одной) находятся в равновесии с газовой фазой. [8]
Кинетический метод А. А. Баландина [37] заключается в определении QiK по опытным значениям энергий активации различных реакций на данном катализаторе. Рассмотрим это на примере трех реакций: 1) дегидрогенизации углеводородов, 2) дегидрогенизации спиртов и 3) дегидратации спиртов. [9]
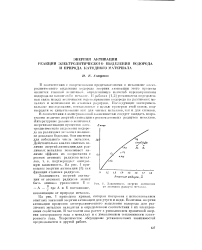 |
Зависимость. шергии активации от атомного радиуса металла. [10] |
На рис. 1 приведена кривая, которая построена с использованием опытных значений энергии активации для ртути и меди. Величина энергии активации процессов электролитического выделения водорода для различных металлов находится в определенном соответствии с их электронными свойствами. В частности она растет с уменьшением граничной энергии электронного газа в металлах и с уменьшением теплоемкости электронного газа. Теоретическое обсуждение установленных зависимостей предполагается в другой работе. [11]
Однако нет доказательств, что зонная модель применима к полимерам, и представление о собственной проводимости в этом случае приводит к некоторым противоречиям. Кроме того, обычное объяснение опытных значений энергии активации проводимости в понятиях зонной теории все еще недостаточно обоснованно. Недостаток данных по эффекту Холла для большинства образцов сильно затрудняет интерпретацию. [12]
Уравнение ( 8) правильно передает зависимость энергии активации процессов электролитического выделения водорода от атомного радиуса металла. На рис. 3 приведены зависимости энергии активации от г. Кривая построена с использованием опытного значения энергии активации для ртути. [13]
Наиболее простой способ сравнения опытных данных с теорией состоит в подстановке в это уравнение найденной на опыте константы скорости реакции второго порядка при средней температуре опыта и радиусов молекул, определенных из спектроскопических данных, если они имеются в распоряжении ( табл. 6 гл. Тогда, используя подходящие значения s, можно решить это уравнение относительно Е и сопоставить найденную величину с опытным значением энергии активации. [14]
СН СН - СНа - СН2 - СН - СН СН2) который замыкается в кольцо соединением двух свободных валентностей. Вы - 1исли е константу скорости димеризации бутадиена [ см8 / ( моль с) яри 61) 0 К, если опытное значение энергии активации равно Еоп 99 024 кДж / моль. Стандартные энтропии даны в таблице. [15]
Страницы: 1 2