Равновесное значение - концентрация
Cтраница 2
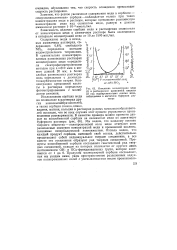 |
Изменение концентрации меди. [16] |
Мы видим, что каждому составу твердого вещества - поликремниевой соли меди отвечают свои равновесные значения концентраций меди и кремниевой кислоты, связанные гиперболической зависимостью. Отсюда видно, что каждый продукт сорбции, имеющий свой состав, действительно представляет собой индивидуальное твердое соединение, а все вместе эти соединения образуют ряд твердых соединений. [17]
Преимущества оксида цинка состоят в том, что в его присутствии ( в отличие от Fe3O4) равновесные значения концентрации сероводорода при температуре гидрообессеривания 370 С приблизительно в сто раз ниже, чем допустимая концентрация. [18]
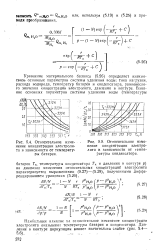 |
Относительное изменение концентрации электролита в зависимости от температуры батареи.| Относительное изменение концентрации электролита в зависимости от температуры конденсатора. [19] |
Уравнение материального баланса (5.26) определяет взаимосвязь основных параметров системы удаления воды: тока нагрузки, расхода водорода, температур батареи и конденсатора, равновесного значения концентрации электролита, давления в контуре. [20]
АС мала, или у - полупроводников, для которых мала разность W - Ас, могут происходить процессы переноса зарядов, то вполне возможно, что реакции твердых органических веществ будут проходить в неравновесных условиях, потому что для достижения равновесных значений концентраций электронов в зоне проводимости и концентраций дырок в валентной зоне необходимо время после того, как эти концентрации изменены под действием на поверхность потоков электронов или света. [21]
Индексы л; и г / относятся соответственно к экстрагируемой фазе и к растворителю: так, в газовом абсорбере х отвечает газу, а у - жидкости; Ux, Uy - приведенные скорости; Ех, Еу - коэффициенты дисперсии, отнесенные к полному поперечному сечению колонны; Сх - равновесное значение концентрации растворенного вещества фазы х по отношению к су в том же сечении колонны. [22]
Атомы О, Н и радикалы ОН вместе с остатками О2 и ( или) Н2 также присутствуют в продуктах реакции при термодинамическом равновесии. Абсолютные равновесные значения концентрации атомов и радикалов неизмеримо малы при температурах около 1000 К, но они постоянно увеличиваются с ростом температуры, хотя и остаются незначительными по сравнению с концентрацией Н2О до температур 2500 К или выше в зависимости от плотности. Если в реагирующей смеси имеется избыток одного из исходных реагентов ( Н2 или О2) по сравнению со стехиометрией, то эти непрореагировавшие молекулы могут оказать определенное влияние на соотношение неосновных продуктов реакции. [23]
Необходимо иметь в виду, что концентрации с ( - в формуле ( IX. Поэтому равновесное значение концентрации ключевого компонента в зерне катализатора зависит от эффективных коэффициентов диффузии. Это является еще одним следствием влияния диффузионного торможения на макрокинетику гетерогенно-каталитических реакций. [24]
Из-за сложности указанной зависимости равновесные значения концентрации газа над р-ром хемосорбента, как правило, находят экспериментально. [25]
Были предложены различные термические способы фиксации атмосферного азота в регенеративных печах и в реакторах различных конструкций и принципов действия. Все эти методы сводятся к получению равновесных значений концентрации окислов азота при температурных режимах, не соответствующих, однако, максимально возможным концентрациям окислов азота. [26]
Для определения стандартных окислительно-восстанозитель-ных потенциалов можно воспользоваться уравнением типа ( VI, 39), если раствор, содержащий окислительно-восстановительную систему, достаточно разбавлен. Поэтому измеряют окислительно-восстановительный потенциал при убывающих равновесных значениях концентраций окисленной и восстановленной форм вещества и затем экстраполируют до нулевых концентраций. [27]
Для определения стандартных окислительно-восстановительных потенциалов можно воспользоваться уравнением типа ( VI, 39), если раствор, содержащий окислительно-восстановительную систему, достаточно разбавлен. Поэтому измеряют окислительно-восстановительный потенциал при убывающих равновесных значениях концентраций окисленной и восстановленной форм вещества и затем экстраполируют до нулевых концентраций. [28]
Для определения стандартных окислительно-восстановительных потенциалов можно воспользоваться уравнением типа (V.52) при условии, если раствор, содержащий окислительно-восстановительную смесь, - идеальный, что достигается только при бесконечном разбавлении. Поэтому измеряют окислительно-восстановительный потенциал при убывающих равновесных значениях концентраций окисленной и восстановленной форм вещества и затем экстраполируют до нулевых концентраций. [29]
Расчет температуры кипения и состава пара определяется в результате решения уравнения ( 13 - 36) с использованием метода секущих ( см. главу 8) путем последовательного уточнения температуры и оформлен в виде процедуры NEW. Выходными параметрами процедуры являются: YR - массив равновесных значений концентраций компонентов в паровой фазе; Т - равновесная температура. [30]
Страницы: 1 2 3 4