Малое значение - энергия - активация
Cтраница 2
По малой их инертности, выражающейся в малых значениях энергии активации и, соответственно, в большой эффективности, реакции атомов Н с галоидами и с галоидоводородами несколько приближаются к реакциям щелочных металлов. [16]
В литературе часто встречается утверждение, согласно которому малые значения энергии активации ( например, порядка 3 - 4 калорий) характеризуют диффузионную кинетику электрохимического процесса, более высокие же значения указывают на наличие определяющей скорость процесса медленной химической или электрохимической стадии. Действительно, снижение энергии активации, связанное с ростом поляризации, во многих случаях переводит электродные процессы из кинетической в диффузионную область. Однако этот вывод не может быть обобщен па все реакции. [17]
Для всех элементов I группы характерны большие коэффициенты диффузии и малые значения энергии активации, что можно рассматривать как свидетельство междоузельного механизма диффузии, осложненного взаимодействием примесей с вакансиями. [18]
Относительно большие значения времен релаксации TI, т2 и тз при малом значении энергии активации свидетельствуют о том, что в процессе участвуют крупные кинетические единицы ( сегменты), которыми могут быть микроблоки надмолекулярной структуры. Объем этих микроблоков составляет 10 - 18 - 10 - 17 см3 или больше. [19]
Таким образом, процесс миграции по Армстронгу не требует преодоления высокого потенциального барьера и сопровождается лишь слабым изменением орбитальных энергий комплекса. В связи с малыми значениями энергии активации на стадии внедрения Армстронг предположил, что стадией, определяющей рост цепи, является координация олефина. [20]
Изменение скорости горения пороха при изменении его начальной температуры сравнительно мало - обычно меньше 0 5 % на градус, а часто и еще меньше. Попытка связать этот малый температурный коэффициент с энергией активации ведущей реакции приводит или к неправдоподобно малым значениям энергии активации, или к слишком высоким значениям температуры поверхности. Однако, по-видимому, такое простое рассмотрение температурной зависимости неприменимо в данном случае. Реакция идет не изотермически, а в области очень большого градиента температуры, где точное приложение концепции энергии активации становится затруднительным. Определяющей скорость горения является скорость поступления энергии к пороху; температура в реакционной зоне подстраивается так, чтобы поддерживать соответствующую скорость. [21]
Как следует из (3.73), для того чтобы был возможен единственный стационарный режим, величина (3.82) должна быть достаточно малой. Таким образом, наиболее вероятно, что единственное стационарное состояние возможно в случае реакции с малыми значениями энергии активации и ( или) малыми значениями теплоты реакции. Увеличение этих параметров приводит к возможности появления множественных стационарных режимов. [22]
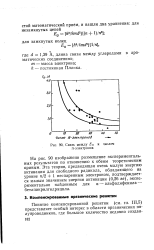 |
Связь между EG зт-элекгронов. [23] |
На рис. 90 изображено размещение экспериментальных результатов по отношению к обеим теоретическим кривым. Эта теория, предвидящая очень малую энергию активации для свободного радикала, обладающего на уровне / г / 2 1 неспаренным электроном, подтверждается малым значением энергии активации ( 0 26 эв), экспериментально найденным для а - альфадифенила - бетапикрилгидрацила. [24]
Их экспериментальные данные показали, что разложение окиси азота идет по второму порядку, а энергия активации меняется от 21 4 ккал / моль при 900 К до 56 6 ккал / моль при 1275 К, что указывает на изменение механизма реакции. По-видимому, малое значение энергии активации и зависимость скорости реакции от отношения поверхности реактора к объему при температуре менее 1000 К свидетельствует о гетерогенном характере процесса. При температуре же выше 1000 К преобладает гомогенная реакция. [25]
Мономерный фталоцианин меди, синтезированный, так же как и ПФМ-2, в присутствии молибдата аммония ( в отличие от полимеров) не обнаруживает каталитической активности в реакции разложения перекиси водорода. Это обстоятельство представляет интерес ввиду сходства структуры мономера и полимера. Это дает основание предполагать, что повышенные значения электропроводности и малые значения энергии активации проводимости являются определенными характеристиками каталитической активности сопряженных систем. [26]
И вместе с тем решающее значение для характеристики деструкционно-окислительных процессов имеет именно стадия развития цепи, точнее соотношение скоростей конкурирующих здесь реакций. В частности, реакция присоединения кислорода к свободному радикалу ( с константой / С2) развивается очень быстро и с малым значением энергии активации. [27]
Влияние температуры на взаимодействие СаО А1203 и 12СаО - 7А1203 с водой заключается в том, что повышение температуры ускоряет процесс. Величины энергий активации, вычисленные из температурной зависимости логарифма начальной скорости взаимодействия, составляют 11.5 0.5 ккал. Малые значения энергий активации подтверждают диффузионный характер гидратации алюминатов. [28]
Процессы в гетерогенных системах ( растворение, установление равновесия между двумя фазами и вообще процессы, связанные с прохождением молекул через какую-либо поверхность раздела) могут протекать со значительными энергиями активации. Эта особенность также характерна для всех систем с большим: молекулярным или частичным весом. Каждая молекула ( или частица), независимо от ее молекулярного веса ( в первом приближении), обладает одним и тем же средним запасом молекулярно-кинетической энергии, но различным количеством полярных групп, вследствие чего активационные барьеры для отдельных групп будут суммироваться. Таким образом, даже при малых значениях энергии активации на 1 моль полярных групп теплота активации на 1 моль высокомолекулярного вещества может представлять собой очень большую величину и при значениях несколько сот малых калорий на 1 моль полярных групп составит в сумме много десятков больших калорий. [29]
Рассмотрим некоторые характерные особенности диффузионно-контролируемых реакций. Во-первых, реакции, лимитируемые диффузией, характеризуются очень высокими значениями констант скоростей. Коэффициенты диффузии небольших молекул в обычных растворителях при обычных условиях имеют порядок 10 - Б см2 - сек-1. Во-вторых, диффузионно-контролируемые реакции обычно характеризуются малыми значениями энергии активации ( 1 - 5 ккал / моль), поскольку, как следует из соотношения (12.12), температурный ход эффективной константы скорости реакции определяется температурным ходом коэффициента диффузии. [30]
Страницы: 1 2 3