Россберг
Cтраница 1
Россберг [32] принимает для энергии активации значение 86 ккал / моль для всех образцов углей, претерпевающих газификацию двуокисью углерода в области, где контролирующей является химическая реакция; при этом он основывается на экспериментальных данных Вике [31], который нашел одинаковую величину энергии активации для угольного электрода высокой степени чистоты и активированного угля средней степени чистоты. Так как опыты Вике проводились в проточной системе при давлении, близком к атмосферному, стадией, определяющей скорость реакции, вероятно, была десорбция комплекса поверхность - кислород. Действительно, наблюдая, что факторы частоты, определенные из констант скоростей, не согласуются с концепцией энергии активации, обусловленной соударением молекул с поверхностью, Вике также делает вывод, что десорбция с поверхности, энергетически стимулируемая тепловыми колебаниями решетки графита, вероятно, является стадией, определяющей скорость реакции. [1]
Россберг [32], принимая для энергии активации значение 50 - 58 ккал / моль, по-видимому, основывается на двух опытах. [2]
Россберг [32], используя два различных типа углерода и тщательно высушив кислород, чтобы исключить вторичный процесс - горение окиси углерода, находит, что температурная зависимость отношения СО / СО2 во всем температурном диапазоне 520 - 1420 полностью совпадает с найденной Артуром зависимостью. Артур и Россберг предполагают, что реакция С СО2 - 2СО не влияет на отношение СО / СОз даже при высоких температурах, с которыми они работали. [3]
Россберг [32] на основании экспериментальных данных Викке для кинетической области установил значение энергии активации для реакции всех типов углерода с двуокисью углерода, равное 86 ккал / моль. [4]
Россберг [32], предлагая значение энергии активации от 50 до 58 ккал / моль, основывался, очевидно, на двух экспериментах. Викке [31], работая на той же экспериментальной установке, которая применялась и для изучения реакции углерода с двуокисью углерода, дает значение 58 4 ккал / моль для размолотого электродного угля. Россберг [32], используя спектрографические углеродные трубки, полученные, очевидно, из одного и того же источника, что и у Викке, дает значение энергии активации 49 5 ккал / моль. При этом автор утверждает, что эти низкие значения не являются результатом некоторого диффузионного торможения. Действительно, если взглянуть на данные Росеберга, то видно, что его значения энергии активации даны с точностью не более 5 ккал / моль. Это означает, что имеется лишь небольшое ( если есть вообще) различие между двумя приведенными выше результатами. [5]
Викке и Россберг 279 ] в своих исследованиях кинетики реакции разложения углем водяного пара сделали также попытку выяснить, какие именно первичные и вторичные реакции играют роль. Исследование проводилось в динамических условиях при протекании пара через угольный канал из хорошо очищенного от золы графита при давлении 0 15 и 1 ата, в пределах температур от 1000 до 1400 С. [6]
Артур и Россберг полагают, что реакция С СО2 - 2СО не влияет на отношение СО: СО2 даже при самых высоких из исследованных ими температур. Кроме того, Артур установил, что величины соотношений СО: СО2, рассчитанные на основании уравнения ( 1) в температурном интервале 900 - 2000, согласуются с относительными скоростями образования этих двух веществ, наблюдавшимися другими исследователями [20, 22, 23] в опытах при таких же температурах и при низких давлениях. [7]
Не ясно, из какого источника Россберг [32] получил предложенную им величину энергии активации порядка 80 ккал / моль для реакции уголь - водяной пар. Вике [31], изучавший реакцию углерод - двуокись углерода, приводят к значению энергии активации для 1 в уравнении ( 10), равному 71 ккал / моль. Недавно Джемс [70], используя проточную систему при изучении реакции графитовых стержней с водяным паром при атмосферном давлении, определил для области, где скорость реакции контролируется химической стадией, суммарную энергию активации, равную 69 ккал / моль. Бинфорд и Эйринг [73], работая в проточной системе с графитовыми стержнями при давлениях ниже 0 1 мм рт. ст., нашли, что энергия активации равна 60 ккал / моль и что реакция имеет нулевой порядок. [8]
Не ясно, из каких источников Россберг [32] получил предложенное им значение энергии активации для реакции углерода с парами воды около 80 ккал / моль. Недавно Джеймс [70], используя поточную систему и графитовые стержни для реакции с парами воды при давлении, близком к атмосферному, определил для кинетической области полную энергию активации в 69 ккал / моль. Бинфорд и Эйринг [73], используя поточную систему и графитовые стержни при давлениях ниже 0 1 мм рт. ст., дают значение энергии активации 60 ккал / моль при нулевом порядке реакции. [9]
Наиболее близко к объяснению образования первичных продуктов подошел и Россберг [12], предложивший модель молекулярных процессов на поверхности угля с учетом величин межФедерных расстояний молекулы кислорода и атомов углерода. Но при этом не были предусмотрены направленность валентных связей и предельно возможные расстояния между ядрами, при которых еще не происходит их разрыв. [10]
Даже для реакции углерода с кислородом, протекающей по первому порядку, сомнительно, имеет ли концепция Россберга какое-нибудь значение, так как кажется необоснованным сравнивать половину энергии диссоциации кислорода с энергией активации реакции. [11]
Вике и сотрудники [31, 32, 81, 82] специально занимались исследованием истинных энергий активации реакций углерода с газами. Россберг [32] предположил, что медленной стадией в этих реакциях является отделение атома кислорода от реагирующих веществ. Поэтому он считает, что энергии активации различных реакций должны быть связаны с энергией, необходимой для диссоциации реагирующих веществ. Данные об энергии диссоциации реагирующего газа и истинных энергиях активации реакций углерода с газами, сопоставленные в табл. 2, свидетельствуют, согласно Россбергу [32], о правильности вышеупомянутой гипотезы. [12]
Россберг [32] предположил, что наиболее медленной стадией в этих реакциях является отделение кислородных атомов от реагирующих молекул. Поэтому он предполагает, что энергия активации различных реакций должна быть связана с энергией, необходимой для диссоциации реагирующих молекул. [13]
Россберг [32], используя два различных типа углерода и тщательно высушив кислород, чтобы исключить вторичный процесс - горение окиси углерода, находит, что температурная зависимость отношения СО / СО2 во всем температурном диапазоне 520 - 1420 полностью совпадает с найденной Артуром зависимостью. Артур и Россберг предполагают, что реакция С СО2 - 2СО не влияет на отношение СО / СОз даже при высоких температурах, с которыми они работали. [14]
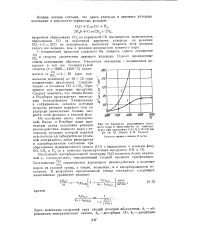 |
Скорость разложения водяного пара в зависимости от температуры при давлениях 1о5 ( / и 73J ( 2 мм рт. ст. ( Е. Викке и К. Гедден. [15] |
Страницы: 1 2