Калориметрическое значение
Cтраница 1
Калориметрические значения были получены из старых, недостаточно точных экспериментальных данных. [1]
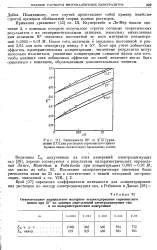 |
Зависимость Е от Yт [ уравнение ( 17 ] для растворов сернокислого цинка Прямые линии соответствуют предельному закону. [2] |
Последние калориметрические значения были уменьшены нами на 25 кал в соответствии с нашей методикой экстраполяции, описанной в гл. [3]
Последние калориметрические значения были уменьшены нами па 25 кал в соответствии с нашей методикой экстраполяции, описанной в гл. [4]
Калориметрические значения Нм для системы ацетон - хлороформ при 50 С получены авторами статьи. [5]
Калориметрические значения величин Ср % и ACPs для более 210 органических соединений в воде приводятся в Приложении IV. Отметим, что в Приложении IV помещены данные для значительного числа соединений, полученные Кабани и соавт. [6]
 |
Обработка данных 11. [7] |
Причина расхождения калориметрических значений Т2 и релаксационных значений Т для этого поли - мера проанализирована в работе А. [8]
После внесения поправок на ассоциацию в газообразном состоянии калориметрическое значение энтропии достаточно хорошо согласуется с результатами расчетов, основанных на спектроскопических методах. Измерения теплоемкости газа, выполненные Фелсингом и Драке [415], также указывают на полимеризацию в газовой фазе. Эти значения хорошо согласуются с результатами Накамуры [1045], полученными на основании констант равновесия реакции между окисью углерода и аммиаком. [9]
После внесения поправок на ассоциацию в газообразном состоянии калориметрическое значение энтропии достаточно хорошо согласуется с результатами расчетов, основанных на спектроскопических методах. Измерения теплоемкости газа, выполненные Фелсингом и Драке [415], также указывают на полимеризацию в газовой фазе. Россини, Вагман, Эванс, Левин и Джаффе [1249] на основании анализа данных по энтальпии образования остановились на значениях & Hf 29S ( l) 25 2 ккал / молъ и & HjlaB ( g) 31 2 ккал / молъ. Эти значения хорошо согласуются с результатами Накамуры [1045], полученными на основании констант равновесия реакции между окисью углерода и аммиаком. [10]
В итоге мы считаем наиболее предпочтительным стандартным состоянием для калориметрических значений ДЯС следующее: температура 25, давление 1 атм, ионная сила 0, концентрации либо в молярной шкале, либо в мольных долях. [11]
В настоящее время не существует единого общепринятого стандартного состояния для калориметрических значений ДЯС. Опубликованные в литературе значения ДЯС относятся к различным стандартным состояниям, и интересно выяснить, какие из этих стандартных состояний более предпочтительны. [12]
При обработке результатов плавок принималось, что весь активный кислород селитры или хромового ангидрида идет на взаимодействие с алюминием, и только в этом случае получено удовлетворительное совпадение подсчитанных и калориметрических значений термичности. Следовательно, активный кислород этих веществ полностью расходуется на окисление алюминия. [13]
Сопоставление полученных значений стандартных теплот образования нитридов алюминия и бора с наиболее надежными калориметрическими данными [3] показывает, что для BN полученная нами величина на 14 5 ккал / моль превышает результаты калориметрических значений, тогда как для A1N разница составляет 43 5 ккал / моль. Эта разница обусловлена тем, что коэффициент испарения нитридов не равен единице. [14]
Очевидно, что при определении энтальпии парообразования соединений, ассоциирующихся в парах, калориметрическим методом и по температурной зависимости давления пара в первом случае полученная величина будет меньше, чем во втором. Следовательно, в случае совпадения калориметрических значений энтальпии парообразования с результатами расчета их из давления пара справедливо будет заключение о том, что полученные данные представляют собой величины энтальпии превращения вещества в мономерный пар. [15]
Страницы: 1 2