Калориметрическое значение
Cтраница 2
Калориметрическая энтропия, определенная описанным выше способом, часто очень хорошо совпадает со спектроскопической энтропией ( разд. В некоторых случаях, однако, калориметрическое значение оказывается более низким. Как правило, это связано с тем, что при статистических расчетах вращение вокруг простых связей предполагается свободным, тогда как в реальной молекуле такое вращение часто заторможено. Благодаря наличию барьера вращение молекулы может осуществляться только в пределах небольших сегментов полной окружности, что приводит к уменьшению энтропии. Число заторможенных состояний зависит от высоты барьера. Термодинамический метод определения барьеров вращения заключается в вычислении высоты барьера, при которой величины калориметрической и спектроскопической энтропии будут совпадать. Уже в 1935 г. Теллер и Топли [32] высказали предположение, что в случае этана можно объяснить все имевшиеся в то время экспериментальные данные ( см. также разд. Обычно между величинами барьеров, определенными с помощью этих двух методов, имеется прекрасное соответствие. [16]
С другой стороны, не исключена вероятность скоррелированного изменения произведения АаГг и разности ( 1 - T2 / Tg) так, что величина fg все же будет приблизительно постоянной. Значения fg, рассчитанные по формуле (11.40) с помощью калориметрических значений Т2 ( см. табл. II. [17]
Это - действительно важный момент, так как на основе значений AGS и ДЯ3 легко вычисляется энтропия растворения A5S без процедуры дифференцирования по температуре. Более того, очень важная характеристика раствора ACps может быть определена из калориметрических значений АЯ5 при разных температурах путем однократного дифференцирования. [18]
Тпл 278 68 К) от содержания в нем нафталина. Из наклона кривой, равного 0 4022, а также из молекулярных весов растворенного вещества и растворителя находят, что L равно 2340 кал / моль, тогда как калориметрическое значение составляет 2348 кал / моль. [19]
Более точное значение - 13 693 кал / г-молъ получено Джиоком и Кемпом [57], которые приняли мольную теплоту парообразования жидкой четырехокиси азота равной 9110 кал. Если закон Генри применить к обоим растворенным веществам, то из уравнения ( 91) следует, что мольные теплоты перехода двуокиси азота N02 из растворов в четыреххлористом углероде и бензоле в газовую фазу составляют соответственно 1980 и 310 кал. Калориметрические значения не известны. [20]
Уаддингтон, Смит, Уильямсон и Скотт [1550] измеряли энтальпию испарения, давление паров и теплоемкость паров при разных температурах. Рассчитанные теплоемкости находились в прекрасном соответствии с калориметрическими значениями, и было предложено принять CS2 в качестве стандартного вещества для паровой калориметрии. [21]
Прежде чем перейти к рассмотрению экспериментальных данных, целесообразно сделать несколько замечаний о состоянии экспериментальных исследований величин ДЯ ДЯ /, ДЯ оь в целом. Важнейшие и наиболее точные методы определения энтальпий растворения - прямые калориметрические измерения. В дальнейшем речь идет почти исключительно о калориметрических значениях. В случае очень малорастворимых соединений, как уже говорилось, для определения ДЯ8 пользуются изучением температурной зависимости растворимости. [22]
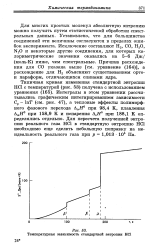 |
Температурная зависимость стандартной энтропии НС1. [23] |
Установлено, что для большинства соединений эти величины согласуются в пределах ошибок эксперимента. Исключение составляют Н2, СО, Н20, N2O и некоторые другие соединения, для которых калориметрические значения оказались на 5 - 6 Дж / ( моль - К) ниже, чем спектральные. Причина расхожде - СО указана выше [ см. уравнение ( 164) ], а з ля Н2 объясняют существованием орто-и параформ, отличающихся спинами ядра. [24]
Дэльман и Ланго [20] указали, что происходящее при процессе разведения смещение ионного равновесия сопровождается заметными тепловыми эффектами. Для полностью диссоциированного хлористого аммония поправка, связанная с гидролизом, имеет тот же порядок величины, что и смещение ( Д 7) при новой экстраполяции. Возможно, что тепловые эффекты, связанные с гидролизом фторидов калия и рубидия, лишь частично компенсируются смещениями Д, приведенными в табл. 121 для этих солей. В качаство примера крайней неопределенности, которая может встретиться при экстраполяции данных по теплотам разведения, зависящих от сдвига ионного равновесия, в гл. XIII, § 13, приведены значения Ь2 для серной кислоты. В этом случае Смещение, необходимое для совмещения калориметрических значений L2 теоретическими, составляет около - 450 кал. [25]
Дэльман и Ланго [20] указали, что происходящее при процессе разведения смещение ионного равновесия сопровождается заметными тепловыми эффектами. В случае разбавленных растворов нейтральных солей тепловой эффект, связанный с изменением степени диссоциации воды, очень мал ( 2 кал на моль соли), однако тепловые эффекты, вызываемые сдвигом равновесия гидролиза или диссоциации таких солей, как, например, сернокислый цинк, неизвестны п могут оказаться весьма значительными. Для полностью диссоциированного хлористого аммония нопранка, связанная с гидролизом, имеет тот же порядок величины, что и смещение ( А 7) при новой экстраполяции. Возможно, что тепловые эффекты, связанные с гидролизом фторидов калия и рубидия, лишь частично компенсируются смещениями Д, приведенными в табл. 121 для этих солей. В качестве примера крайней неопределенности, которая может встретиться при экстраполяции данных по теплотам разведения, зависящих от сдвига ионного равновесия, в гл. XIII, § 13, приведены значения L2 для серной кислоты. В этом случае смещение, необходимое для совмещения калориметрических значений L2 теоретическими, составляет около - 450 кал. [26]
Страницы: 1 2