Активационный сверхпотенциал
Cтраница 1
Активационный сверхпотенциал ц определяется как Е - Eeq и, следовательно, имеет отрицательное значение при катодной поляризации и положительное - при анодной. [1]
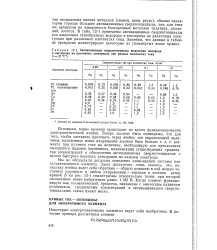 |
Активационные сверхпотенциалы выделения водорода и кислорода на различных электродах при разных плотностях тока. [2] |
В табл. 12 - 1 приведены активационные сверхпотенциалы для выделения газообразных водорода и кислорода на различных электродах при различных плотностях тока. Заметим, что данные в таблице прекрасно иллюстрируют некоторые из упомянутых выше правил. [3]
 |
Идеализированные кривые ток-потенциал. [4] |
Такая кривая отражает характеристики, включая любой активационный сверхпотенциал, процессов происходящих только на рабочем электроде. [5]
Для того чтобы через электрод проходил ток конечной - величины, необходим сдвиг потенциала от его равновесного значения. Такой сдвиг потенциала при отсутствии изменений концентрации вблизи электрода называется активационным сверхпотенциалом. На рис. 14 - 2 схематически показано поведение отдельного электрода. Общий ток, проходящий через электрод, является алгебраической суммой двух противоположных токов. [6]
Для некоторых реакций, таких как восстановление катиона металла на поверхности ртути с образованием амальгамы, активационный1 сверхпотенциал, необходимый для быстрого переноса электронов, мал. Для других процессов, которые сводятся к образованию или разрыву химических связей, активационный сверхпотенциал, необходимый для быстрого переноса электрона, значительно больше. Хотя невозможно предсказать значение активационного сверхпотенциала, при котором начнется реакция электронного переноса, протекающая с определенной скоростью, существуют некоторые качественные закономерности. Во-вторых, с повышением температуры активационный сверхпотенциал понижается, поскольку часть энергии активации процесса переноса электронов обеспечивается за счет термической энергии. В-третьих, что характерно, активационные сверхпотенциалы больше для реакций, связанных с выделением газов, окислением или восстановлением органических молекул и с многоэлектрон-переносами. В-четвертых, выделение одного металла на поверхности электрода из другого металла часто происходит с некоторым активационным сверхпотенциалом вплоть до момента, когда поверхность электрода полностью покрывается слоем выделяемого на нем металла. [7]
Особенно трудно получить количественные данные для полуреакций металл - ион металла в связи с трудоемкостью приготовления чистых и воспроизводимых поверхностей. Для металлов, легко дающих обратимый потенциал в присутствии одноименных ионов ( Си, Ag, Zn, Cd, Hg), плотность обменного тока сравнительно высока; следовательно, при плотностях тока, обычно используемых в электроанализе, активационный сверхпотенциал невелик. Эти металлы в растворах своих ионов ведут себя не в соответствии с формулой Нернста, так как при этом оказывают влияние другие потенциалопределяющие системы, что приводит к появлению смешанного потенциала вследствие существования двух или более окислительно-восстановительных пар. Трудно также произвести количественные исследования ( особенно на твердых электродах) кинетики полуреакций, проходящих с обменом электронами между окислителями и восстановителями, находящимися в растворе. Так, убедительно доказано23 - 24, что в присутствии сильных окислителей или при высоких положительных значениях потенциала поверхность платины покрывается окисной пленкой. [8]
Однако ртутный капающий электрод по сравнению с другими микроэлектродами обладает тремя преимуществами. Во-первых, непрерывный рост и падение капель ртути означают, что каждые несколько секунд свежая поверхность электрода подвергается действию раствора; в соответствии с этим процесс электролиза на предыдущих каплях не влияет на изучаемую реакцию. Во-вторых, большой активационный сверхпотенциал выделения газообразного водорода на ртути делает ртутный капающий электрод ценным для изучения катодных процессов, а именно, в большинстве случаев для изучения восстановления ионов металлов. В-третьих, с данным электродом возможно получить воспроизводимый предельный диффузионный ток, который количественно связан с концентрацией реагирующих частиц. [9]
Подобные рассуждения приводят к заключению, что в том случае. II) даже в отсутствие градиента концентрации, потенциал медного электрода в цинк-медной ячейке нужно сдвинуть в положительном направле нии от значения потенциала, при котором отсутствует ток. Таким образом, существует активационный сверхпотенциал, связанный с процессом переноса электронов у каждого электрода в электролитической ячейке. [10]
Для некоторых реакций, таких как восстановление катиона металла на поверхности ртути с образованием амальгамы, активационный1 сверхпотенциал, необходимый для быстрого переноса электронов, мал. Для других процессов, которые сводятся к образованию или разрыву химических связей, активационный сверхпотенциал, необходимый для быстрого переноса электрона, значительно больше. Хотя невозможно предсказать значение активационного сверхпотенциала, при котором начнется реакция электронного переноса, протекающая с определенной скоростью, существуют некоторые качественные закономерности. Во-вторых, с повышением температуры активационный сверхпотенциал понижается, поскольку часть энергии активации процесса переноса электронов обеспечивается за счет термической энергии. В-третьих, что характерно, активационные сверхпотенциалы больше для реакций, связанных с выделением газов, окислением или восстановлением органических молекул и с многоэлектрон-переносами. В-четвертых, выделение одного металла на поверхности электрода из другого металла часто происходит с некоторым активационным сверхпотенциалом вплоть до момента, когда поверхность электрода полностью покрывается слоем выделяемого на нем металла. [11]
Мы не обсуждали детально поведение цинк-медной системы как гальванического элемента. Здесь достаточно лишь сказать, что, поскольку ячейка ведет себя обратимо - общую реакцию в ней можно заставить протекать в любом направлении - верхняя и нижняя ветви кривой Б на рис. 12 - 1 симметричны относительно точки, при которой наложенное извне напряжение равно 1 100 В. Когда элемент функционирует как гальванический, процессы, связанные с омическим падением потенциала, градиентами концентраций и активационными сверхпотенциалами, также имеют место. [12]
Можно показать ( доказательство здесь не приводится), что сдвиг потенциала цинкового электрода в отрицательную область понижает энергетический барьер для прямой реакции и одновременно повышает энергетический барьер для обратной реакции. Поэтому сдвиг потенциала цинкового катода в более отрицательную область по сравнению с его равновесным значением, когда суммарный ток равен нулю, способствует восстановлению цинка ( II) до металла и протеканию суммарного катодного тока. Сдвиг потенциала электрода, который приводит к протеканию некоторого суммарного тока ( в отсутствие какого-либо градиента концентраций) называется активационным сверхпотенциалом. Если неоходимо увеличить суммарный ток для восстановления цинка ( II) до металла, потенциал катода следует сдвинуть в значительной мере в отрицательную область, иначе говоря, чем больший ток требуется, тем большим должен быть активационный сверхпотенциал. [13]
Особенно трудно получить количественные данные для полуреакций металл - ион металла в связи с трудоемкостью приготовления чистых и воспроизводимых поверхностей электродов. Тщательное удаление органических примесей позволяет получать воспроизводимые результаты измерений ток - напряжение. Для металлов, легко дающих обратимый или почти обратимый потенциал в присутствии одноименных ионов ( Си, Ag, Zn, Cd, Hg), плотность обменного тока сравнительно высока; следовательно, при плотностях тока, обычно используемых в электроанализе, активационный сверхпотенциал невелик. Эти металлы в растворах своих ионов ведут себя не в соответствии с формулой Нернста из-за влияния других потенциалопределяющих систем, что приводит к появлению смешанного потенциала при наличии двух или более окислительно-восстановительных пар. Трудно также провести количественные исследования ( особенно на твердых электродах) кинетики полуреакций, проходящих с обменом электронами между окислителями и восстановителями, находящимися в растворе. Так, убедительно доказано [20] ( см., например, рис. 14 - 4), что в присутствии сильных окислителей или при высоких положительных значениях потенциала поверхность платины покрывается оксидной пленкой. [14]
Для некоторых реакций, таких как восстановление катиона металла на поверхности ртути с образованием амальгамы, активационный1 сверхпотенциал, необходимый для быстрого переноса электронов, мал. Для других процессов, которые сводятся к образованию или разрыву химических связей, активационный сверхпотенциал, необходимый для быстрого переноса электрона, значительно больше. Хотя невозможно предсказать значение активационного сверхпотенциала, при котором начнется реакция электронного переноса, протекающая с определенной скоростью, существуют некоторые качественные закономерности. Во-вторых, с повышением температуры активационный сверхпотенциал понижается, поскольку часть энергии активации процесса переноса электронов обеспечивается за счет термической энергии. В-третьих, что характерно, активационные сверхпотенциалы больше для реакций, связанных с выделением газов, окислением или восстановлением органических молекул и с многоэлектрон-переносами. В-четвертых, выделение одного металла на поверхности электрода из другого металла часто происходит с некоторым активационным сверхпотенциалом вплоть до момента, когда поверхность электрода полностью покрывается слоем выделяемого на нем металла. [15]
Страницы: 1 2