Четырехвалентный свинец
Cтраница 3
Сурик РЬ3О4 - смешанную окись двух - и четырехвалентного свинца - получают, нагревая порошкообразную окись свинца ( П) ( массикот) на воздухе. При нагревании до высокой температуры сурик разлагается с выделением кислорода ( стр. [31]
Привести примеры различных типов солей, которые образует гидроокись четырехвалентного свинца. [32]
 |
Схема разряда свинцового аккумулятора. [33] |
В литературе5 имеются указания на то, что сульфат четырехвалентного свинца устойчив лишь на холоду, в очень концентрированных ( с уд. [34]
IX, § 11) основано на окислительных свойствах соединений четырехвалентного свинца и на их переходе в устойчивые соединения двухвалентного свинца. Аккумуляторы составлены из свинцовых пластин с нанесенной на них окисью свинца. Пластины погружают в раствор серной кислоты. Сначала происходит реакция образования сульфата свинца. [35]
Так как для свинца более характерно двухвалентное состояние, производные четырехвалентного свинца являются сильными окислителями. [36]
Чисто случайное стерическое направление имеет радикальное [770] окисление олефиноп ацетатом четырехвалентного свинца, которое иногда сопровождается рядом побочных реакций. [37]
В химических соединениях свинец чаще всего двухвалентен, но встречается и четырехвалентный свинец. Кристаллизуется свинец в кубической системе. При низких температурах свинец обладает сверхпроводимостью. [38]
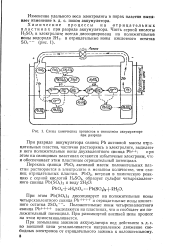 |
Схема химических процессов в свинцовом аккумуляторе. [39] |
При этом Pb ( SO4) 2 диссоциирует на положительные ионы четырехвалентного свинца. Положительные ионы четырехвалентного свинца РЬ выделяются на пластинах, что и сообщает им положительный потенциал. При разомкнутой внешней цепи процесс на этом приостанавливается. [40]
Соли двухвалентных германия и олова - сильные восстановители, а соединения четырехвалентного свинца обладают сильным окислительным действием. Переход от низшей валентности к высшей осуществляется обычно в щелочной, а обратный переход - в кислой среде. [41]
Аналогично можно, конечно, проводить алкилирование с помощью других солей четырехвалентного свинца. Процесс алкилирования является, повидимому, автокаталитическим. Промотором может служить переносчик водорода, превращающий группу RCOO в свободную карбоновую кислоту или, как полагает Гей 2, облегчающий первоначальный распад тет-раацетата свинца. [42]
РЬ ( ОН) 4 растворяются как в кислотах с образованием солей двухвалентного и четырехвалентного свинца, так и в растворах едких щелочей с образованием растворимых солей, производных от кислот Н2РЬ02 и Н2РЬ03, содержащих свинец в составе аниона. [43]
В отличие от аналогичных соединений олова эти соединения более устойчивы, чем соединения четырехвалентного свинца; это свидетельствует о более резко выраженном металлическом характере свинца. Поэтому соединения двухвалентного свинца не проявляют восстановительных свойств, а, наоборот, соединения четырехвалентного свинца являются окислителями и стремятся переходить в двухвалентное состояние. Соединения четырехвалентного свинца образуются при действии сильных окислителей на соединения двухвалентного свинца. Известно меньшее число соединений четырехвалентного свинца, чем двухвалентного свинца, причем они имеют более ограниченное практическое значение. [44]
Каждые два электрона, поступившие с отрицательного электрода, будут восстанавливать положительный иОн четырехвалентного свинца до двухвалентного иона свинца РЬ2, который переходит в электролит и соединяется с ионом S0ii -, образуя молекулу сульфата свинца. Сульфат свинца, обладая малой растворимостью, отлагается на поверхности положительного электрода в виде мелких кристаллов. Наряду с этим процессом происходит взаимодействие гидроксильных ионов ( 4ОН -), образовавшихся в результате распада гидроксила свинца РЬ ( ОН) 4 на ионы, е четырьмя ионами водорода ( 4Н) - продуктами диссоциации серной кислоты, в результате чего образуются четыре молекулы воды. Следовательно, на каждые две израсходованные молекулы серной кислоты и две молекулы воды образуется вновь четыре молекулы воды. [45]
Страницы: 1 2 3 4