Термодинамическое свойство - вещество
Cтраница 1
Термодинамические свойства вещества, находящегося в ультрадисперсном состоянии отличаются от свойств вещества в крупнокристаллическом виде, прежде всего появлением зависимости этих свойств не только от внутренней структуры, но и от формы и размера наночастиц частиц. Высокая поверхностная энергия и малый размер УДЧ углерода вызывают соответствующие изменения энтальпии и энтропии вещества. В данной работе для наночастиц графита и алмаза в жидкой и твердой фазах были сконструированы УРС на основе соответствующих крупнокристаллических фаз углерода с учетом изменения энергии Гиббса и энтропии УДЧ, обусловленного высокой поверхностной энергией наночастиц. Изменение энтропии и энтальпии образования вещества в ультрадисперсном состоянии, связанное с изменением размера, формы и структуры УДЧ, а также учетом зависимости поверхностной энергии ( коэффициента поверхностного натяжения) от температуры, сводилось к коррекции этих величин ( энтальпии образования вещества и энтропии) в стандартных условиях. [1]
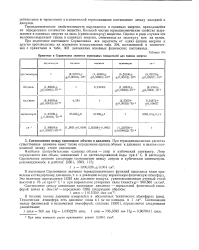 |
Принятые в Справочнике значения переводных множителей для единиц энергии. [2] |
Термодинамические свойства веществ выражаются в единицах энергии, приходящейся на определенное количество вещества. Большей частью термодинамические свойства выражаются в единицах энергии на моль ( грамм-молекулу) вещества. Однако в ряде случаев эти величины выражают также в единицах энергии, отнесенных на молекулу или на грамм. [3]
Так как термодинамические свойства вещества предполагаются известными, то г - известная функция уже введенных величин р и р, и уравнение ( 14) либо ( 15) дает недостающую связь для определения искомых газодинамических величин. [4]
В таблицах все термодинамические свойства веществ ( и частиц) выражены в ккал / моль или в кал / К-моль; кал термохимические. Дж / К-моль, указанные значения должны быть умножены на 4 184 ( точно. Параметры реакций отнесены к количествам веществ, указанным в уравнении реакции. [5]
Если необходимо вычислить термодинамические свойства малоисследованного вещества, то поступают следующим образом. Если такое совпадение имеет место, то на основании уравнения состояния или таблиц термодинамических свойств эталонного вещества при одинаковых, я и т вычисляют термические и калорические свойства исследуемого вещества. [6]
Если необходимо вычислить термодинамические свойства малоисследованного вещества, то поступают следующим образом. Если такое совпадение имеет место, то на основании уравнения состояния или таблиц термодинамических свойств эталонного вещества при одинаковых я и т вычисляют термические и калорические свойства исследуемого вещества. [7]
Статистическая термодинамика позволяет рассчитывать термодинамические свойства вещества на основании строения и свойств молекул. [8]
Термодинамические функции состояния характеризуют термодинамические свойства вещества. К их числу наряду с внутренней энергией U и энтальпией Я относятся энтропия 5, энергия Гельм-гольца F и энергия Гиббса G. Термодинамические функции состояния являются экстенсивными свойствами: их величины зависят от количества ( массы) вещества. [9]
Термодинамические функции состояния характеризуют термодинамические свойства вещества. К их числу наряду с внутренней энергией U и энтальпией Я относятся энтропия S, энергия Гельмгольца F и энергия Гиббса G. Термодинамические функции состояния являются экстенсивными свойствами: их величины зависят от количества вещества. Именно поэтому At /, АЯ, AS, AF и AG принято относить к одному молю вещества и выражать в кДж / моль, имея в виду, что и объем V в произведении pV [ см. уравнение ( IV. [10]
По принципу соответственных состояний термодинамические свойства веществ ( в том числе и коэффициенты сжимаемости различных газов), имеющих одинаковые приведенные температуры и давления, приблизительно одинаковы, так как различные газы находятся при этом как бы в одинаковом относительном приближении к жидкому состоянию. Поэтому графики ( в приведенных координатах) коэффициента сжимаемости Z углеводородов одного гомологического ряда совпадают с достаточной для практики точностью. Поэтому график, приведенный на рис. 10, можно использовать для вычисления удельного объема и других параметров любого газа ( в том числе и газовых смесей), если известны его критические параметры. [11]
В ряде глав параграф Термодинамические свойства веществ в твердом и жидком состояниях отсутствует в связи с тем, что в этих главах рассматриваются только вещества в газообразном состоянии. [12]
По принципу соответственных состояний термодинамические свойства веществ ( в том числе и коэффициенты сжимаемости различных газов) с равными приведенными температурой и давлением приблизительно одинаковы, так как при этом различные газы находятся как бы в одинаковом относительном приближении к жидкому состоянию. Поэтому графики коэффициента сжимаемости z в приведенных координатах для углеводородов одного гомологического ряда совпадают с точностью, достаточной для практики. [13]
Теплообмен, гидродинамика и термодинамические свойства веществ. [14]
Обобщен обширный материал по термодинамическим свойствам веществ, относящихся к различным классам кислородсодержащих органических соединений. Даны критические обзоры литературных данных и таблицы рекомендуемых значений. Приводятся величины теплоемкости, энтальпии, энтропии, энергии Гиббса, теплот фазовых превращений, теп-лот образования и термодинамических констант для твердого, жидкого и газообразного состояния вещества. [15]
Страницы: 1 2 3