Термодинамическое свойство - индивидуальное вещество
Cтраница 1
Термодинамические свойства индивидуальных веществ: Справочное изд. [1]
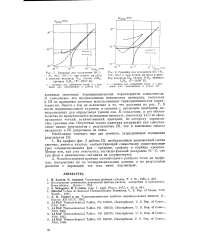 |
Границы зон осаждения SiC - f.| Границы зон осаждения SiC - f - Si, SiC, SiC C при. подаче на вход в реактор водорода И2, силана SiH4, пропана С3Н8 ( 7 - 2000 К. [2] |
Гурвич и др. Термодинамические свойства индивидуальных веществ. [3]
Появившиеся обобщенные данные по термодинамическим свойствам индивидуальных веществ [87], вычисленные квантово-ста-тистическим методом, позволяют уточнить значения энтальпии и констант равновесия данных реакций. [4]
Однако современный уровень знаний о термодинамических свойствах индивидуальных веществ, молеку-лярно-кинетическая теория и развитие вычислительной техники позволяют поставить задачу расчета равновесных свойств произвольных по исходному составу смесей. В предлагаемой работе на основе развитых ранее методов определения свойств многокомпонентных идеальных газовых смесей [1, 2] и общих термодинамических соотношений [7, 8] предложен универсальный метод расчета равновесного состава и свойств неидеальных смесей, удобный для реализации на ЭЦВМ. [5]
Обширная сводка данных по константам равновесия реакций в газовой фазе содержится в справочнике Термодинамические свойства индивидуальных веществ, Изд. [6]
Изложение этих методов и примеры основанных на них расчетов даны в справочнике: Термодинамические свойства индивидуальных веществ. [7]
Широкое внедрение термодинамических методов и открывающиеся в этой области перспективы требуют накопления данных о термодинамических свойствах индивидуальных веществ, причем круг рассматриваемых веществ, а также диапазон температур, для которых необходимы соответствующие данные, непрерывно расширяются. Так, если до конца тридцатых годов для практических расчетов были необходимы главным образом данные о термодинамических свойствах обычных газов и простейших углеводородов в интервале температур от комнатной до 1500 - 3000 К, то к началу пятидесятых годов потребовались сведения о термодинамических свойствах десятков неорганических соединений при температурах до 5000 - 6000 К, а в последующие годы для расчетов высокотемпературных процессов оказались необходимыми данные для температур до 20000 - 25000 К. [8]
Вычислите произведение растворимости Са ( ОН) 2 при 298 К, использовав данные о термодинамических свойствах индивидуальных веществ и ионов в водных растворах. [9]
Это издание не ставит перед собой задачи подробного и всестороннего обсуждения всех приведенных данных подобно справочнику Термодинамические свойства индивидуальных веществ под редакцией акад. [10]
Это издание не ставит перед собой задачи подробного и всестороннего обсуждения всех приведенных данных, подобно справочнику Термодинамические свойства индивидуальных веществ под редакцией акад. [11]
При высоких температурах, когда кинетические факторы не играют существенной роли 1 теоретическое исследование процессов может быть проведено достаточно строго на основании термодинамических расчетов, если известны данные о термодинамических свойствах индивидуальных веществ, принимающих участие в этих процессах. Этим объясняется непрерывно возрастающий за последние годы интерес к изучению термодинамических свойств веществ, в особенности газов, при высоких температурах, а также все более широкое применение термодинамических методов исследования в самых разнообразных областях науки и техники. Можно отметить, что большие успехи, достигнутые за последние годы в теплотехнике, нефтехимии, металлургии и некоторых других областях, непосредственно связаны с применением термодинамических расчетов. [12]
Более полный обзор статистических методов расчета термодинамических функций газов дан в гл. II книги Термодинамические свойства индивидуальных веществ, АН СССР, 1962, где особое внимание уделено расчетам для высоких температур. [13]
Функцию Ф ( Т) называют приведенной энергией Гиббса. Она табулирована в справочниках по термодинамическим свойствам индивидуальных веществ. [14]
За последние несколько лет начали проводиться расчеты термодинамических функций газов при температурах выше 5000 - 6000 К, главным образом для газов, входящих в состав воздуха. К сожалению, в этой работе отсутствуют сведения о термодинамических свойствах индивидуальных веществ, образующих воздух. [15]
Страницы: 1 2