Экспериментальное значение - длина - связь
Cтраница 2
Одно из важнейших применений понятия о порядках связей заключается в предсказании длин связей. Если провести плавную кривую через основные точки, соответствующие простой, двойной и тройной связям, то можно определить длину желаемой связи, зная порядок связи, и наоборот. Именно с помощью экспериментальных значений длин связей была сделана оценка степени ионности молекул фурана, пиррола и тиофена ( стр. [16]
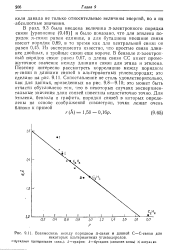 |
Взаимосвязь между порядком л-связи и длиной С-С - связи для. [17] |
Из эксперимента известно, что простые связи длиннее двойных, а тройные связи еще короче. В бензоле я-электрон-ный порядок связи равен 0 67, а длина связи СС имеет промежуточное значение между длинами связи для этана и этилена. Поэтому интересно рассмотреть корреляцию между порядком л-связи и длинами связей в альтернантных углеводородах; это сделано на рис. 9.11. Сопоставление не столь удовлетворительно, как для данных, приведенных на рис. 9.8 - 9.10; это может быть отчасти обусловлено тем, что в некоторых случаях экспериментальные значения длин связей известны недостаточно точно. [18]
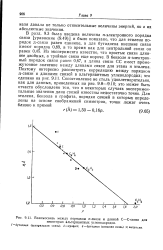 |
Взаимосвязь между порядком я-связи и длиной С-С - связи для. [19] |
Из эксперимента известно, что простые связи длиннее двойных, а тройные связи еще короче. В бензоле я-электрон-ный порядок связи равен 0 67, а длина связи СС имеет промежуточное значение между длинами связи для этана и этилена. Поэтому интересно рассмотреть корреляцию между порядком я-связи и длинами связей в альтернантных углеводородах; это сделано на рис. 9.11. Сопоставление не столь удовлетворительно, как для данных, приведенных на рис. 9.8 - 9.10; это может быть отчасти обусловлено тем, что в некоторых случаях экспериментальные значения длин связей известны недостаточно точно. [20]
Нам остается только подсчитать электроны - по два на каждую орбиталь. Атом углерода предоставляет четыре валентных электрона, и по одному электрону дает каждый атом водорода. Отметим, что двум парам электронов ( этого достаточно для образования двух ординарных связей) удается удерживать вместе три атома. Экспериментальное значение длины связи С - Н, равное 1 03 А, соответствует нормальной ординарной связи, что согласуется с этим предсказанием. [21]
Вычисление всех этих интегралов не составляет слишком большого труда ( см., например, гл. Вычисленная при таком межъядерном расстоянии полная энергия составляет - 1 0974 ат. Энергия двух изолированных атомов водорода равна - 1 0 ат. Следовательно, предсказываемая данным расчетом энергия диссоциации ( вычисленная относительно истинного предела изолированных атомов) равна 0 0974 ат. Экспериментальное значение длины связи для молекулы Нг равно 1 40 ат. Найденные из расчета по методу МО результаты оказываются качественно правильными, но их численные значения не слишком точны. [22]
 |
Ковалентные радиусы атомов, вычисленные на основании длин одинарных связей ( пм. [23] |
Эти значения получаются сложением ковалентных радиусов двух связанных атомов. Крвалентный радиус данного атома А равен половине экспериментально измеренной длины связи А-А. Так, измеренная длина связи С-С равна 154 пм, поэтому ковалентный радиус углерода принимается равным 77 пм. С - С1 вычисляется как сумма 77 и 99 пм и равна 176 пм. Экспериментальное значение длины связи в четы-реххлористом углероде равно 177 пм и находится в хорошем согласии с расчетным. [24]
Страницы: 1 2