Взаимодействие - железо
Cтраница 2
При взаимодействии железа, воды и воздуха образуются гидроокислы. Наличие в ржавчине воды и водорастворимых гидроокислов приводит к тому, что ржавчина представляет собой пористый слой, иногда очень рыхлый. [16]
При взаимодействии железа с концентрированной азотной кислотой на его поверхности образуется прочная оксидная пленка, которая замедляет доступ к железу ионов из раствора, реакция дальше практически не протекает, и поэтому концентрированную азотную кислоту можно транспортировать в железных цистернах. [17]
При взаимодействии железа с серой образуются след. С сульфидирующим реагентом взаимодействуют также и др. элементы, причем нек-рые из них, напр. [18]
При взаимодействии железа, воды и воздуха образуются гидроокислы. Наличие в ржавчине воды и водорастворимых гидроокислов приводит к тому, что ржавчина представляет собой пористый слой, иногда очень рыхлый. [19]
При взаимодействии железа с сульфосалициловой кислотой в щелочной среде получается желтое окрашивание раствора, интенсивность окраски которого возрастает с увеличением содержания железа. [20]
При взаимодействии железа с концентрированной азотной кислотой на его поверхности образуется прочная оксидная пленка, которая замедляет доступ к железу конов из раствора, реакция дальше практически не протекает, и поэтому концентрированную азотную кислоту можно транспортировать в железных цистернах. [21]
Провести реакцию взаимодействия железа с разбавленными соляной, серной и азотной кислотами. [22]
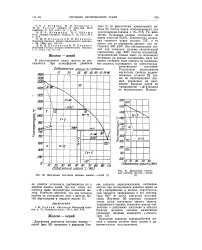 |
Диаграмма состояния системы железо - церий ГП.| Диаграмма состояния системы железо - церий Г4 ]. [23] |
Истинный характер взаимодействия железа с церием должен быть решен в дополнительных исследованиях. [24]
Из реакции взаимодействия железа с окисью углерода в интервале температур 500 - 600 К с наибольшей глубиной превращения протекает реакция ( V-3), приводящая к образованию магнетита и цементита. Эта реакция, по-видимому, является основным процессом, обусловливающим наличие в порошковом карбонильном железе связанных кислорода и углерода. [25]
Из реакций взаимодействия железа с углекислотой следует, как уже отмечалось, что в интервале температур 500 - - 600 К реакция ( V-5), протекающая с образованием магнетита и окиси углерода, практически невозможна. Реакция ( V-6), приводящая к образованию магнетита и элементарного углерода, формально протекает с большой глубиной превращения. Однако уравнение ( V-6) является суммой удвоенного уравнения ( V-12) и уравнения ( V-5), поэтому, как и уравнение ( V-2), оно не должно приниматься во внимание. [26]
Почему при взаимодействии железа с хлором и соляной кислотой образуются продукты различного состава. [27]
Как сообщалось, взаимодействие железа с водяным паром протекает энергичнее, чем с атмосферой воздуха ( 700 - 1100 С [343, 747]; 650 - 1050 С [860]), по той причине, что в водяном паре образуется только FeO с высокой концентрацией дефектов, а защитное действие Fe3O4 отсутствует. [28]
Особенно легко происходит взаимодействие железа с хлором, поскольку образующийся FeCl3 при слабом нагревании летуч и не создает на поверхности металла защитной пленки. Наоборот, фториды данных металлов нелетучи ( вследствие значительной ионности связи Э - F), поэтому Fe, Co и особенно Ni при не слишком высоких температурах устойчивы к действию фтора. [29]
Особенно легко происходит взаимодействие железа с хлором, поскольку образующийся FeCh при слабом нагревании летуч и не создает на поверхности металла защитной пленки. Наоборот, фториды данных металлов нелетучи ( вследствие значительной ионности связи Э - F), поэтому Fe, Co и особенно Ni при не елишком высоких температурах устойчивы к действию фтора. [30]
Страницы: 1 2 3 4