Взаимодействие - железо
Cтраница 3
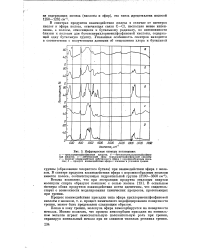 |
Инфракрасные спектры поглощения. [31] |
В спектрах продуктов взаимодействия железа в отличие от спектров кислот и эфира полоса, отвечающая связи С - С1, несколько менее интенсивна, а полосы, относящиеся к бутильному радикалу, по интенсивности близки к полосам для бутокситрихлорметилфосфиновой кислоты, содержащей одну бутильную группу. [32]
Согласно расчету реакция взаимодействия железа с аммиаком ( V-7), приводящая к образованию нитрида Fe4N и водорода, в рассматриваемых условиях процесса протекает с небольшой глубиной превращения. В действительности же порошковое карбонильное железо, полученное в присутствии аммиака, всегда содержит азот, связанный с металлом. Это указывает на то, что процесс воздействия аммиака на железо целиком не описывается уравнением ( V-7) и в действительности протекает более сложно, например, как это указывает ряд авторов, с образованием карбонитридов железа. [33]
Написать уравнение реакции взаимодействия железа с нитратом калия, учитывая, что продуктами реакции являются окись железа, окись калия и свободный азот. [34]
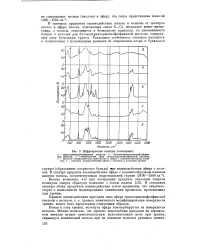 |
Инфракрасные спектры поглощения. [35] |
В спектрах продуктов взаимодействия железа в отличие от спектров кислот и эфира полоса, отвечающая связи С - С1, несколько менее интенсивна, а полосы, относящиеся к бутильному радикалу, по интенсивности близки к полосам для бутокситрихлорметилфосфиновой кислоты, содержащей одну бутильную группу. [36]
Предлагается новое объяснение взаимодействия железа и углерода в железо-углеродистых сплавах. Приведены результаты масс-и ИК-спектроскопии осадков проб, полученных при растворении кислотами серого чугуна. Показано, что в его составе присутствуют углеродные скопления в виде фуллеренов, что подтверждает предложенную модель фуллеренного строения железо-углеродистых сплавов. [37]
Метод основан на взаимодействии железа ( II) с о-фенантролином с образованием комплексного соединения оранжево-красного цвета. Максимальное поглощение лучей окрашенным соединением наблюдается около 530 ммк. [38]
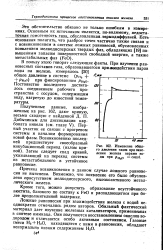 |
Изменение общего давления газов при окислении железа парами воды при / Н20 const. [39] |
Ложные равновесия при взаимодействии железа с водой неоднократно отмечались рядом авторов. Обильный фактический материал дает изучение железных катализаторов, применяемых в синтезе аммиака. Они получаются восстановлением окислов водородом и отличаются особо активным состоянием. [40]
Например, при взаимодействии железа с алюминием и ниобия с кобальтом через прослойку расплава висмута на поверхности железа и ниобия образуются интерметаллиды. В случае взаимодействия железа с кобальтом и никелем в той же среде на поверхности железа отлагается слой твердого раствора. Возможен также перенос неметаллических элементов, в частности углерода, который перемещается от менее сильных к более сильным карбидообразователям. [42]
Метод основан на взаимодействии железа с сульфосалициловой; кислотой, которая образует в аммиачной среде с Fe ( III) комплекс, окрашенный в желтый цвет. [43]
Влияние углерода на реакции взаимодействия железа с кислородсодержащими газами определяется в большой мере обезуглероживанием при температурах выше приблизительно 700 С. Как известно и как это неоднократно подтверждалось ( см., например, работу Остина [745]), обезуглероживание стали водородом сильно ускоряется IB присутствии водяного пара или при использовании листовой стали с цветами побежалости. Если углеродсодержащее железо соприкасается с газом, содержащим кислород даже в малой примеси, то образующаяся окись углерода создает значительное давление, зависящее от температуры, концентрации углерода в стали и концентрации кислорода Б газовой среде. Ясно, что выделение окиси углерода ( наряду с углекислым газом) должно отразиться на окислении сталей. [44]
Таким образом, реакция взаимодействия железа с углекислотой в реальных условиях процесса термического разложения Fe ( CO) 5, по-видимому, не имеет места. [45]
Страницы: 1 2 3 4