Взаимодействие - центральный ион
Cтраница 1
Взаимодействие центральных ионов и лигандов может быть объяснено с помощью обобщенной теории кислот и оснований Льюиса, однако координационную связь можно рассматривать в принципе и как крвалентную с примесью ионной составляющей и описать ее методом ЛКАО. В комплексах переходных элементов важную роль играют d - орбитали, состояние которых зависит от пространственного расположения и типа лигандов. Для понимания электронного строения комплексов существенны данные об их электронных спектрах и магнитных свойствах, правильная интерпретация которых невозможна без рассмотрения характера расщепления d - орбиталей в полях различной симметрии. [1]
После взаимодействия центрального иона с лигандами образовавшийся комплекс имеет меньший запас энергии, чем отдельно взятые компоненты. [2]
При этом ( окислительно-восстановительном) взаимодействии центрального иона с лигандом естественно растет степень ковалентности ( ср. Следует отметить, что металлы типа платины, палладия, ртути характеризуются высокими значениями электродных потенциалов. Из сказанного следует, что устойчивость в растворе производных упомянутых металлов увеличивается по мере повышения степени ковалентности связи металл - лиганд, а эта последняя растет с возрастанием электродного потенциала и потенциала ионизации металла и с уменьшением сродства к электрону лиганда. [3]
После внесения необходимых поправок в экспериментальные данные получают значения АЯ, характеризующие энергетику взаимодействия центрального иона или-ганда. [4]
Открытие целой совокупности фактов, тесно связанных с понижением симметрии октаэдрических комплексов, несомненно, позволит лучше понять природу еще одного вида слабого взаимодействия, на этот раз нарушающего центральную симметрию взаимодействия центрального иона с лигандами. Некоторые из полученных результатов являются весьма неожиданными, даже в рамках теорий, учитывающих нецентральный характер взаимодействия в комплексах. [5]
 |
Вычисленные по методу МОХ и экспериментальные значения энергии делокализации Ео. [6] |
Координационное соединение построено из центрального иона и лигандов. Взаимодействие центрального иона и лигандов имеет электростатический характер. Равновесная конфигурация определяется балансом сил притяжения и отталкивания ионов ( или иона и диполей) и для многих соединений может быть предсказана из электростатических соображений. [7]
Координационное соединение построено из центрального иона и лигандов. Взаимодействие центрального иона и лигандов имеет электростатический характер. [8]
 |
Структура ион [ Са - 6Н20 ] 2.| Взаимодействие диполей. [9] |
Таким образом, эффективный: момент равен ц в aBzAe / a2 ц, в X X [ 1 aBzAe / ( Be2) ] - Третий член в уравнении (7.55) дает энергию притяжения диполя лиганда к центральному иону. Далее идет член, выражающий взаимодействие центрального иона с моментом, который этот ион индуцирует в лиганде. Стабильная структура комплекса должна соответствовать минимальной энергии и, полученной путем приравнивания du / da нулю. При тех числовых значениях, которые были приведены выше, энергия будет минимальной при расстоянии между ионом и молекулами воды 2 32 А и будет равна - 284 ккал / г-ион. Энергия устойчивой конфигурации складывается из. [10]
 |
Модель ионной кающими в растворах сильных электроли-атмосферы TQB gM6CTO практически недоступного ра. [11] |
Энергия этого взаимодействия зависит от плотности заряда ионной атмосферы и ее среднего радиуса. С ростом концентрации раствора электролита плотность заряда ионной атмосферы растет, а ее средний радиус уменьшается, что увеличивает энергию взаимодействия центральных ионов с их ионными атмосферами. [12]
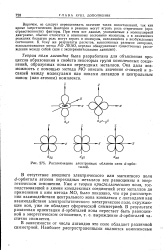 |
Расположение электронных облаков пяти rf - орби. [13] |
В отсутствие внешнего электрического или магнитного поля d - орбитали атомов переходных металлов все равноценны в энергетическом отношении. Уже в теории кристаллического поля, господствовавшей в химии комплексных соединений этих металлов до применения к ним метода МО, было показано, что при рассмотрении взаимодействия центрального иона комплекса с лигандами как взаимодействия электростатического электрическое поле, окружающее ион, уже не обладает сферической симметрией. [14]
Определим энергию электростатического взаимодействия одного выбранного иона с остальными. В первой координационной оболочке, как это видно из рис. XXIV. Энергия взаимодействия центрального иона с ними равна 6e2 / d, где d - период решетки. [15]
Страницы: 1 2