Взаимодействие - катион
Cтраница 1
Взаимодействие катиона с молекулой воды происходит, по-видимому, путем образования донорно-акцепторной связи через атом кислорода, благодаря наличию у него неподеленной пары электронов. Это ведет к смещению электронного облака атома кислорода к катиону, которое тем больше, чем больше эффективный заряд катиона. [1]
 |
Скорость окисления бутантиола-1 воздухом в присутствии метилата натрия в различных растворителях. [2] |
Взаимодействие катиона с амидной группой диполярных апротонных растворителей, например при использовании ДМФ, идет более интенсивно с образованием прочного комплексного соединения, что еще больше повышает силу основания. [3]
Взаимодействие катиона с алкеном, а следовательно, и рост цепи продолжаются до тех пор, пока катион остается достаточно устойчивым, а в реакционной смеси еще достаточно алкена. Эта цепь в конце концов может оборваться из-за какого-то процесса, который разрушит катиоыный центр, например если путем потери протона вновь образуется алкен. [4]
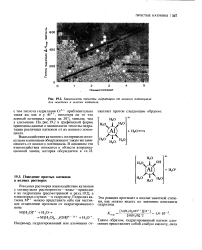 |
Зависимость теплоты гидратации от ионного потенциала для жестких и мягких катионов. [5] |
Взаимодействия катионов с полярными молекулами и анионами обнаруживают такую же зависимость от ионного потенциала. В основном эти взаимодействия относятся к области координационной химии, которая обсуждается в гл. [6]
Рассмотрим взаимодействие катиона металла М с лигандом L в растворе при постоянной ионной силе. [7]
Энергии взаимодействия катионов в органической фазе ( образование ассоцнатов, сольватация) невелики, а следовательно, невелика и их разность. В системах с пзоампловым спиртом, как указывалось, весьма большую роль играет процесс сольватации фенолятов растворителем. Различия в устойчивости образующихся ассоциатов и их сольватации в органической фазе становятся определяющим фактором. Натрий, несмотря на большую энергию гидратации в водном растворе, в подобных системах экстрагируется лучше цезия. [8]
Скорость взаимодействия катиона диазония с гидроксильным ионом, приводящего к получению диазотата, и скорость изомеризации последнего в антидиазотат очень сильно зависят от влияния заместителей в ароматическом кольце. Электроноакцепторные заместители облегчают течение этих превращений. [9]
При взаимодействии катиона с лигандом, например с этилен-диаминтетрауксусной кислотой ( ЭДТА), молекула этого гексаден-татного комплексона может предоставить для образования шести связей шесть пар электронов. Ион кобальта предоставляет этим электронам шесть эквивалентных орбиталей в результате следующей перегруппировки: d - электроны, находившиеся каждый на своей орбитали, спариваются, освобождая при этом для гибридизации две d - орбитали. [10]
При взаимодействии катиона с лигандом, например с этилен-диаминтетрауксусной кислотой ( ЭДТА), молекула этого гексаден-татного комплексона может предоставить для образования шести связей шесть пар электронов. Ион кобальта предоставляет этим электронам шесть эквивалентных орбиталей в результате следующей перегруппировки: й-электроны, находившиеся каждый на своей орбитали, спариваются, освобождая при этом для гибридизации две с. [11]
При взаимодействии подобных катионов с анионом S внешние электронные оболочки катиона и аниона сильно деформируются, и возникающая между ними связь приближается к ковалентной. Образующиеся при этом сульфиды устойчивы и труднорастворимы в воде. [12]
При взаимодействии подобных катионов с анионом S внешние электронные оболочки катиона и аниона сильно деформируются, и возникающая между ними связь приближается к ковалентной. Образующиеся при этом сульфиды устойчивы и труднорастворимы в воде. [13]
При взаимодействии катионов металлов с комплексоном III в водных растворах увеличивается концентрация водородных ионов, что приводит к повышению электропроводности раствора. [14]
При взаимодействии катионов металлов с ЭДТА в водных растворах увеличивается концентрация водородных ионов, что приводит к повышению электропроводности раствора. При избытке титранта H2Y2 - - ионы начинают взаимодействовать с находящимися в растворе Н - ионами, так как кислотные свойства этилендиаминтетрауксусной кислоты слабо выражены ( рКа 2 0; 2 62; 6 16; 10 26), концентрация Н в результате этого уменьшается, что приводит к понижению электропроводности раствора. Таким образом, при количественном взаимодействии катионов металлов с ЭДТА точки эквивалентности расположены в максимумах на кондуктометрических кривых. [15]
Страницы: 1 2 3 4