Взаимодействие - атом - хлор
Cтраница 2
Уже эти данные позволяют сделать предположение о механизме реакции хлора с водородом. Вероятно, первым актом данного взаимодействия является разрыв молекулы хлора на атомы, следующим - взаимодействие атомов хлора с молекулой водорода. [16]
Cl, C1) составляют по энергии такую же долю полной разности энергий, как и в случае только метил - или только галогензамещенных этана при таком же взаимном расположении взаимодействующих групп. Так, например, предполагается, что в случае 2 3-диметил - 2 3-дихлорбутана С1 ( СН3) 2С - С ( СН3) 2С1 энергия взаимодействия атомов хлора такая же, как А. [17]
В результате установлено, что реакции присоединения и замещения с участием алифатических полихлоруглеводородных радикалов протекают с некоторой стереонаправленностью. В процессе этих реакций фиксируется кон-формационное состояние радикала, отвечающее следующим условиям: а) минимальным торзионным напряжениям при переходе от spz - к / 3-гиб-ридизованному атому углерода, б) минимальным несвязанным взаимодействиям телогена или мономера с заместителем в растущем радикале в у-по-ложении от радикального центра; в) минимальным взаимодействиям атомов хлора и углерода в концевом звене радикала. [18]
В последнее время намечаются тенденции получения на основе высокомолекулярных соединений и термореактивных покрытий. Для этой цели можно использовать полимеры, содержащие в цепи функциональные группы, которые обеспечивают образование сетчатой структуры ( отверждение) за счет химических реакций. Так, отверждение поливинилхлорида может происходить за счет взаимодействия атомов хлора полимера с аминами. [19]
Низкий квадрупольный момент этого ядра делает его одним из наиболее трудных для изучения, но в то же время это одна из наиболее благодарных областей исследований. Помимо слабости резонанса имеется еще одно обстоятельство, усложняющее в настоящее время его интерпретацию. В случае С135 и вообще атомов галогенов возможно измерение градиента поля, возникающего благодаря одному р-электрону ( qp), путем измерения констант взаимодействия атома хлора в опытах с атомными пучками. В случае азота это невозможно в связи с тем, что его основное состояние обладает сферической симметрией 4S и поэтому qp для азота должно быть рассчитано иным путем, например из функций Слетера. Метод измерения состоит в наблюдении резонанса N14 в твердом молекулярном азоте, где градиент возникает вследствие / 2 р-электрона; возможно также улавливание N2 в отверстиях подходящей кристаллической решетки. [20]
Инициирование сводится к отщеплению атома хлора от молекулы хлорсодержащего соединения. Развитие цели происходит в результате отрыва атома водорода от другой молекулы хлорсодержащего углеводорода этим атомом хлора с образованием хлористого водорода и хлоруглеводо-родкого радикала. Этот радикал самопроизвольно отщепляет атом хлора у fi - углеродного атома с образованием ненасыщенного соединения. Обрыв цепи происходит при взаимодействии атомов хлора и хлоруглеводородных радикалов. Эта схема, очевидно, приводит к уравнению первого порядка для общей реакции. [21]
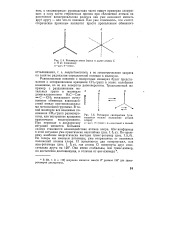 |
Ротамеры этана ( здесь и далее атомы С и Н не показаны. а-цис -. б-транс -.| Ротамеры дихлорэтана ( учитывается только положение атомов хлора. а - цис -. б - транс -. в - гош - ( левый и правый. [22] |
Равносильным понятию о поворотных изомерах будет представление о заторможенном вращении СН3 - групп в этане: колебания возможны, но не все повороты равновероятны. Традиционный же пример с раздвижением ме-тильных групп в молекуле диметилацетилена Н3С - С С - СН3 показывает исчезновение обменных взаимодействий между противоположными метальными группами. В такой молекуле все взаимные положения СН3 - групп равновероятны, или внутреннее вращение практически незаторможено. При переходе к дихлорэтану ситуация меняется. Большим злом становится взаимодействие атомов хлора. [23]
Исследования Боденштейна, а затем Нернста, показали что при освещении смеси водорода и хлора молекула хлора, поглощая квант световой энергии hv, распадается на атомы. Атомы хлора вступают в соединение с водородом, в результате чего происходит взрыв смеси. Активация одной молекулы хлора должна была бы вызвать образование двух молекул НС1, однако опыты показывают, что при этом образуется 100 000 молекул хлористого водорода. Это можно объяснить, если предположить, что при взаимодействии атома хлора с водородом образуется продукт, который, вступая во вторичные реакции, вновь возрождается, и может продолжать реакцию. [24]
Этот тип так называемого отрыва водорода ( hydrogen abstraction) очень распространен в качестве переносящей цепь стадии гемолитического замещения в насыщенных соединениях. Собственно говоря, происходит замещение у атома водорода, которое несомненно протекает через линейное переходное состояние. При хлорировании метана эта стадия реакции, как следует из данных табл. 60, термонейтральна; для гомологичных алканов она слабо экзотермична. Это позволило Тротман-Диккенсону и его сотрудникам, проведшим конкурентное хлорирование водорода и метана, путем сопоставления скоростей с известной абсолютной скоростью хлорирования водорода получить абсолютные значения скоростей взаимодействия атома хлора с метаном. [25]
Страницы: 1 2