Взаимодействие - металл
Cтраница 3
Взаимодействие металлов с металлами приводит к образованию в большинстве случаев металлоподобных соединений - интерметалли-дов. Чаще всего эти соединения более тугоплавки, чем исходные металлы, и химически более инертны. Характер межатомной связи в интерметаллидах определяется свойствами его компонентов. Если один из компонентов проявляет металлоидные свойства, то связь в соединении имеет большую долю ионности, так как доля электронов, отдаваемых атомами в коллективное владение всеми атомами, уменьшается. Например: MgAg - типичный интерметаллид с металлическим характером связи, соединение Mg2Sn - проявляет полупроводниковые свойства, a Mg3N2 и MgO - соединения металла с неметаллом имеют ионную связь. [31]
Взаимодействие металлов с кислотами относится к числу окислительно-восстановительных процессов. [32]
Взаимодействие металлов с концентрированными кислотами и характер этого взаимодействия в значительной степени зависят от свойств самой кислоты. Кислоты, обладающие сильно выраженными окислительными свойствами ( например, HNO3 концентрированная H2SO4), окисляя металл, сами восстанавливаются, причем степень восстановления зависит от свойств металла, его химической активности. [33]
Взаимодействие металлов с металлами и неметаллами определяет их металлохимические свойства [6]: электронное строение атомов, соотношение атомных радиусов взаимодействующих металлов, положение элементов в ряду электроотрицательности, валентности и потенциалы ионизации атомов. Эти свойства определяют, в каких случаях возникают металлические твердые растворы, образуются металлические соединения, с какими элементами металлы дают только механические смеси или же совсем не взаимодействуют. [34]
Взаимодействие металла с внешней средой при электрохимической коррозии сопровождается двумя самостоятельными процессами. [35]
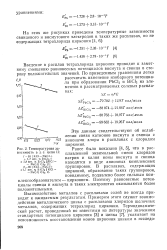 |
Температурная зависимость э. д. с. цепи II. [36] |
Взаимодействие металлов с расплавами солей не всегда приводит к ожидаемым результатам. Примером этого служит взаимодействие металлического цинка с расплавами хлоридов щелочных металлов, содержащих тетрахлорид циркония. [37]
Взаимодействие металлов, осаждающихся на катоде, играет существенную роль при электроосаждении сплавов. [38]
Взаимодействие металлов между собой может приводить к различным продуктам в зависимости от природы металлов. [39]
Взаимодействие металлов с хлороводородной ( соляной) кислотой. Окислителем в соляной кислоте, так же как и в воде, является ион водорода. Стандартный электродный потенциал водородного электрода приравнен к нулю. Поэтому принципиально все активные металлы и металлы средней активности должны реагировать с кислотой. [40]
Взаимодействие металлов с такими газами, как СО, СО2, Н2, Н2О, лежит в основе пирометаллургических процессов. [41]
Взаимодействие металлов с кислотами является окислительно-восстановительным процессом. [42]
 |
Изменение сопротивления контактов в эксплуатации. [43] |
Взаимодействие металла контактов с агрессивными газами приводит к появлению пленки на поверхности металла. Однако при этом увеличивается и падение напряжения на контакте, и градиент электрического поля в пленке, разделяющей контакты, и температура площадки соприкосновения. [44]
Взаимодействие металла сварочной ванны с электролитом, который представляет собой расплавленный шлак, особенно проявляется при сварке под слоем флюса, электрошлаковом процессе и при сварке-покрытыми электродами. [45]
Страницы: 1 2 3 4