Взаимодействие - щелочной металл
Cтраница 1
Взаимодействие щелочного металла с растворенным ароматическим соединением приводит к образованию ароматических углеводородных анионов. [1]
При взаимодействии щелочных металлов с ароматическими углеводородами в тетрагидрофуране или в аналогичном растворителе образуются интенсивно окрашенные растворы. В присутствии винилового мономера эти высокоактивные частицы быстро исчезают. [2]
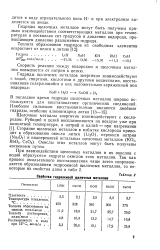 |
Свойства гидроокисей щелочных металлов. [3] |
При взаимодействии щелочных металлов и их окислов с водой образуются гидраты окислов этих металлов. [4]
При взаимодействии щелочных металлов или их окисей с водой образуются гидроокиси щелочных металлов - щелочи - это сильные основания, основные свойства которых возрастают с увеличением атомного номера элемента. [5]
При взаимодействии щелочных металлов с сухим газообразным аммиаком при обыкновенном давлении наблюдаются следующие изменения. Натрий при - 20 С и ниже покрывается синими каплями, быстро приобретающими медно-красный цвет, а при дальнейшем действии аммиака наступает образование раствора сначала медно-красного, а затем синего цвета. Калий начинает реагировать при 0 С и более низких температурах и претерпевает также внешние изменения, переходя в раствор синего цвета, сохраняющий свою окраску даже при концентрации калия 1 / 40 000 N. Литий способен реагировать с газообразным аммиаком уже при комнатной температуре и выше - вплоть - до 60 С, также образуя в конечном итоге синюю жидкость, отличающуюся особой стойкостью. Вопрос о том, образуют ли щелочные металлы определенные соединения с аммиаком, в настоящее время, по-видимому, решается отрицательно. [6]
При взаимодействии щелочного металла массой 4 6 г с иодом образуется иодид массой 30 г. Какой щелочной металл был взят для реакции. [7]
По легкости взаимодействия щелочных металлов с элементами V, VI групп реакция напоминает ионные реакции, хотя речь идет о полимерных гомеополярных формах элементов V, VI групп. Причем если для полимерных форм элементов VI группы ( серы в частности) еще можно говорить о некоторой весьма незначительной растворимости в жидком аммиаке, то, например, красный фосфор в жидком аммиаке совершенно нерастворим, в то-время как в аммиачном растворе щелочного металла он растворяется мгновенно. [8]
Даже при взаимодействии щелочных металлов с галогенами не происходит полного удаления электрона у щелочного металла и присоединения его к атому галогена. Из рис. 18 видно, что в области между ионами Na и С1 сохраняется незначительное перекрывание АО ( зона А), остается небольшой электронный мостик между ядрами атомов. [9]
Как изменяется характер взаимодействия щелочных металлов с водой и кислородом в зависимости от размера атома. [10]
Гидроксиды образуются при взаимодействии щелочных металлов или их оксидов с водой. [11]
Не следует приводить примеры взаимодействия щелочных металлов с кислотами. [12]
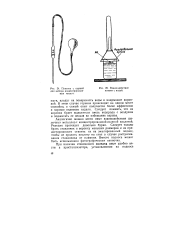 |
Пипетка с грушей для набора концентрированных кислот.| Взаимодействие натрия с водой. [13] |
Аналогично можно вести опыт взаимодействия щелочных металлов с концентрированной соляной кислотой. Реакция протекает довольно бурно. Следует только брать стаканчик и воронку меньших размеров и из предосторожности ставить их на эмалированный поднос, чтобы не пролить кислоту на стол в случае растрескивания стаканчика от пламени. Вместо подноса может быть использована фотографическая ванночка. [14]
Вещество, полученное при взаимодействии щелочного металла массой 2 66 г с избытком хлора, растворили в воде и к полученному раствору добавили избыток нитрата серебра. [15]
Страницы: 1 2 3 4