Взаимодействие - молибден
Cтраница 3
 |
Структура некоторых изо - и гетерополианионов, построенных из октаэдрических групп МоОб и VfOt. [31] |
Известны гексагалогениды МоРб, WFe, WCla, WBre. Их получают взаимодействием молибдена или вольфрама с избытком галогена. [32]
Было проведено термографическое изучение реакции взаимодействия молибдена с селеном. При 340 С начинается взаимодействие селена с молибденом. Взаимодействие молибдена с селеном в стехиометрических соотношениях 1: 1, 1: 1 33, 1: 1 5 -приводят к образованию низших халькогенидов, имеющих некоторую область гомогенности. [33]
Трибромид МоВгз и трииодид МоЬ образуются при взаимодействии молибдена с бромом и иодом. [34]
Этот экспериментальный факт, по-видимому, можно объяснить тем, что адгезия пленок молибдена к графиту больше, чем на окисных подложках и, следовательно, сплошность пленки должна наступить при меньшей общей толщине пленки. По-видимому, также нужно учитывать, что при взаимодействии молибдена с графитом образуется карбид молибдена, смачивающийся металлом гораздо лучше, чем окисные соединения молибдена. В системе С - Mo - Sn ( Топ 900 С) критическая толщина равна, как и в системе С - Мо - Си ( Гоп 1150 С), 200 А. Это можно объяснить тем, что уже при температуре 900 С взаимодействие пленки с подложкой настолько велико, что дальнейшее повышение температуры до 1150 С не очень сказывается на структуре пленки. Если взаимодействие пленки с подложкой сильное, то продукты реакции смачиваются хуже, чем металл пленки, критическая толщина сдвигается в сторону больших толщин. Так, в системе С - Fe - Pb критическая толщина при температуре опыта 700 С о составляет 1000 А, а в системе С - V - Sn ( Топ 900 С) со 700 А. Эти данные соответствуют времени отжига пленок не больше 5 мин. При отжиге больше 5 мин получаются нестабильные результаты и критическая толщина сдвигается еще больше в сторону увеличения толщины пленки. Действительно, убыль свободной энергии А / 7 при образовании карбидов молибдена Мо2С и карбида железа Fe3C приблизительно одинакова и равна 0 75 ккал / моль ( 700 С); а для карбидов ванадия она значительно больше - 26, 1 ккал / моль ( 900 С), что находится в хорошем соответствии с полученными данными по смачиванию. [35]
По крайней мере три из молибденсодержащих ферментов - ксантиноксидаза, альдегидоксидаза и нитратредуктаза - содержат одновременно флавиновый кофактор. По данным исследований методом ЭПР [44, 74, 124], в этих ферментах имеет место перенос электрона между молибденом и флавиновым кофактором, что привело к предположению о непосредственной связи молибдена с молекулой флавина. В связи с этим было исследовано взаимодействие молибдена с различными флавинами как возможная модель ферментативного электрон-транспортного процесса. [36]
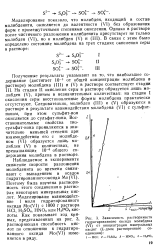 |
Зависимость растворимости гидратироваиного оксида молибдена ( VI от концентрации минеральных кислот ( L-доля растворенного соединения. [37] |
Полученные результаты указывают на то, что наибольшее содержание ( достигает 10 - 3 от общей концентрации молибдена в растворе) молибдена ( III) и ( V) в растворе соответствует стадии III. На стадии II окисления серы в растворе образуется лишь молибден ( V), причем в незначительных количествах: на стадии I окисления серы восстановленные формы молибдена практически отсутствуют. Следовательно, молибден ( III) и ( V) образуются в растворе в результате взаимодействия молибдена ( VI) с сульфит-ионом, при этом сульфит-ион окисляется до сульфат-иона. Восстановительные свойства тиосульфат-иона проявляются в значительно меньшей степени: при взаимодействии его с молибденом ( VI) образуется лишь молибден ( V) в количествах, не превышающих 10 - 6 общего содержания молибдена в растворе. [38]
Было проведено термографическое изучение реакции взаимодействия молибдена с селеном. При 340 С начинается взаимодействие селена с молибденом. Взаимодействие молибдена с селеном в стехиометрических соотношениях 1: 1, 1: 1 33, 1: 1 5 -приводят к образованию низших халькогенидов, имеющих некоторую область гомогенности. [39]
Рассмотрение потенциостатических кривых показывает, что кривые для железа, никеля и хрома имеют аналогичную форму и содержат четыре области растворения, характерных для пассивирующихся металлов: активное состояние, переходная область от активного к пассивному состоянию, пассивная область и область перепассивации. Для молибдена [37, 38, 62, 63, 65] и вольфрама [63] удается установить только часть пассивной области и область перепассивации. Обусловлено это тем, что фкор рассматриваемых металлов находится в начале области перепассивации. Поэтому исследовать полностью пассивную область и достичь активного состояния не представляется возможным, так как для поддержания потенциалов в указанных областях нужны плотности катодных токов, выходящие за пределы практически реализуемых плотностей. По-видимому, вследствие высокого сродства к кислороду, уже в условиях очень больших скоростей выделения водорода ( - 0 1 а / см2) происходит адсорбцион-но-химическое взаимодействие молибдена и вольфрама с кислородом воды и их пассивирование. [40]
Страницы: 1 2 3